
13价肺炎球菌多糖结合疫苗(破伤风类毒素/白喉类毒素)
13 Jia Feiyanqiujun Duotang Jiehe Yimiao(Poshangfeng Leidusu/Baihou Leidusu)
13-valent Pneumococcal Polysaccharide Conjugate Vaccine(TT/DT)
本品系采用纯化的1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F型肺炎链球菌荚膜多糖抗原,分别经活化后与载体蛋白共价结合为多糖蛋白结合物,加入磷酸铝佐剂及辅料后制成。其中部分型别荚膜多糖抗原分别经活化后与破伤风类毒素共价结合为多糖蛋白结合物,部分型别荚膜多糖抗原分别经活化后与白喉类毒素共价结合为多糖蛋白结合物。用于预防由上述13种血清型肺炎链球菌引起的肺炎、脑膜炎、中耳炎和菌血症等疾病。
1 基本要求
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造
2.1 菌种
生产用菌种为13种血清型肺炎链球菌菌种(1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F型),来源应明确。
2.2 原液
2.2.1 精制多糖
1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F型肺炎球菌精制多糖应符合“23价肺炎球菌多糖疫苗”中2.1~2.2项的规定。
2.2.2 精制多糖检定
按3.1项进行。
2.2.3 保存与保存时间
粗制多糖、精制多糖于-20℃或以下保存,保存时间应符合批准的要求。
2.2.4 裂解多糖
2.2.4.1 多糖裂解
各型别肺炎球菌精制多糖分别溶解至适宜浓度,过滤后用均质机处理,经超滤浓缩、洗滤、冻干即得各型肺炎球菌裂解多糖。或按另行批准的工艺制备。
2.2.4.2 裂解多糖检定
按3.2项进行。
2.2.4.3 保存与保存时间
于-20℃或以下保存,保存时间应符合批准的要求。
2.2.5 载体蛋白
2.2.5.1 白喉类毒素
白喉类毒素原液的制造及检定应符合“吸附白喉疫苗”2.1~2.2项规定。可采用分子排阻色谱法或其他经批准的方式对白喉类毒素原液进一步纯化,经0.2μm过滤或通过适当的微生物控制后,即为白喉类毒素载体。
2.2.5.2 破伤风类毒素
破伤风类毒素原液的制造及检定应符合“吸附破伤风疫苗”2.1~2.2项规定或经批准的其他方法。可采用分子排阻色谱法或其他经批准的方式对破伤风类毒素原液进一步纯化,经0.2μm过滤或通过适当的微生物控制后,即为破伤风类毒素载体。
2.2.5.3 载体蛋白的检定
按3.3项进行。
2.2.5.4 保存与保存时间
保存温度及时间应符合批准的要求。
2.2.6 肺炎球菌多糖蛋白结合物的制备
2.2.6.1 结合
将各相应血清型的肺炎球菌裂解多糖用注射用水溶解,加入适宜pH值的缓冲液至合适浓度并搅拌混匀。搅拌状态下,加入适量活化剂进行活化反应后,按比例加入稀释后的白喉类毒素载体或破伤风类毒素载体,搅拌反应一定时间,加入适宜终止溶液终止反应。
2.2.6.2 纯化
将上述反应结束后的各血清型肺炎球菌多糖蛋白结合物按批准的方法经澄清过滤、超滤浓缩后,采用分子排阻色谱法或其他经批准的工艺进一步纯化,收集的结合物纯化液经除菌过滤后,即为肺炎球菌多糖蛋白结合物原液。
2.2.7 肺炎球菌多糖蛋白结合物原液检定
按3.4项进行。
2.2.8 保存及保存时间
于2~8℃保存,保存时间应符合批准的要求。
2.3 半成品
2.3.1 半成品配制
按批准的处方将13种单型肺炎球菌多糖蛋白结合物原液混合,除菌过滤后,加入适量稀释剂、辅料搅拌混匀,加入磷酸铝佐剂吸附,可补加适量稀释剂、辅料等。或按另行批准的工艺制备。
2.3.2 半成品检定
按3.5项进行。
2.4 成品
2.4.1 分批
应符合生物制品分包装及贮运管理(通则0239)规定。
2.4.2 分装
应符合生物制品分包装及贮运管理(通则0239)规定。
2.4.3 规格
每支0.5ml。每1次人用剂量0.5ml,各型肺炎球菌多糖含量应符合批准的要求。
2.4.4 包装
应符合生物制品分包装及贮运管理(通则0239)规定。
3 检定
3.1 精制多糖检定
3.1.1 鉴别试验
采用免疫双扩散法(通则3403),各型多糖应与其相应的特异性抗血清产生明显沉淀线;或采用速率比浊法(照“23价肺炎球菌多糖疫苗”3.3.2项),应可测出各单型多糖含量。
3.1.2 检查
3.1.2.1 固体总量
依法测定(通则3101),各型精制多糖干燥至恒重。
3.1.2.2 蛋白质含量
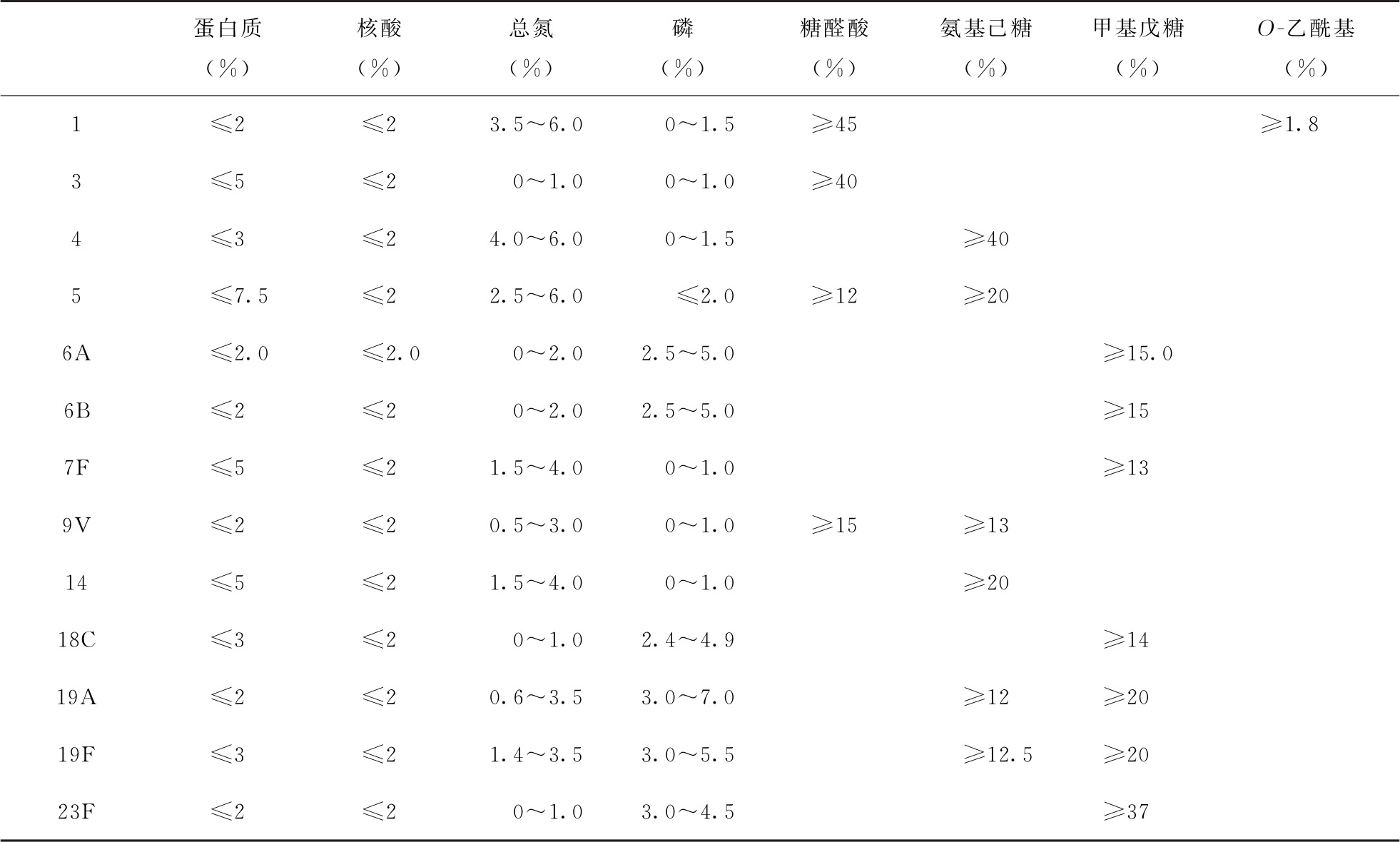
依法测定(通则0731第二法 方法1),各型蛋白质含量限度见表1。
3.1.2.3 核酸含量
依法测定(通则0401),核酸在260nm波长处的吸收系数(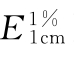 )为200,各型核酸含量限度见表1。
)为200,各型核酸含量限度见表1。
3.1.2.4 O-乙酰基含量
依法测定(通则3117)1型精制多糖的O-乙酰基含量,含量限度见表1。
3.1.2.5 磷含量
依法测定(通则3103),或采用经批准的其他方法,各型磷含量限度见表1。
3.1.2.6 糖醛酸含量
照“23价肺炎球菌多糖疫苗”3.1.2.6项测定。1、3、5、9V型精制多糖的糖醛酸含量限度见表1。
表1 各型精制多糖检定各相关项目限度要求
3.1.2.7 甲基戊糖含量
照“23价肺炎球菌多糖疫苗”3.1.2.7项测定。6A、6B、7F、18C、19A、19F、23F型精制多糖的甲基戊糖含量限度见表1。
3.1.2.8 氨基己糖含量
照“23价肺炎球菌多糖疫苗”3.1.2.8项测定。4、5、9V、14、19A、19F型精制多糖的氨基己糖含量限度见表1。
3.1.2.9 总氮含量
依法测定(通则0704第三法)或采用经批准的其他方法,各型总氮含量限度见表1。
3.1.2.10 多糖分子大小分布测定
采用经批准的方法测定,各型多糖KD值及其回收率应符合批准的要求。
3.1.2.11 有机溶剂残留量
依法测定(通则0861),或采用经批准的其他方法,应符合批准的要求。
3.1.3 细菌内毒素检查
依法检查(通则1143),各型细菌内毒素检查含量应小于0.5EU/μg。
3.2 裂解多糖检定
3.2.1 分子大小分布测定
采用经批准的方法测定,各型多糖的KD值及其回收率应符合批准的要求。
3.2.2 细菌内毒素检查
依法检查(通则1143),应不高于0.5EU/μg。
3.3 载体蛋白检定
3.3.1 蛋白质含量
依法测定(通则073 1第二法方法1),应不低于50mg/ml。
3.3.2 单体含量
照分子排阻色谱法(通则0514)测定或采用经批准的其他方法,按面积归一化法计算。
色谱条件 用葡聚糖-琼脂糖复合基质为填充剂;以0.15mol/L氯化钠或其他适宜溶液为流动相;检测波长为280nm;进样体积为0.5ml。
测定法 分别取破伤风类毒素载体与白喉类毒素载体,注入液相色谱仪,记录色谱图。
限度 破伤风类毒素载体单体含量应不低于85%,白喉类毒素载体单体含量应不低于90%。
3.3.3 细菌内毒素检查
依法检查(通则1143),应不高于10EU/mg。
3.3.4 无菌检查
依法检查(通则1101),应符合规定。
3.4 肺炎球菌多糖蛋白结合物原液检定
3.4.1 鉴别试验
采用免疫双扩散法(通则3403),各型别肺炎球菌多糖蛋白结合物原液应分别与对应型肺炎球菌特异性抗血清(或抗血清因子)及相应的破伤风抗毒素或白喉抗毒素产生明显沉淀线。或采用经批准的其他方法。
3.4.2 多糖含量
3.4.2.1 3、4、6A、6B、7F、9V、14、18C、19A、19F和23F型多糖含量
依法测定(通则0401)或采用经批准的其他方法测定。
多糖参考品贮备液 精密称定各型别多糖参考品125mg,加25ml水充分溶解,制成每1ml中约含5mg的溶液,照固体总量测定法(通则3101)测定其固体总量。取该溶液适量,用水稀释制成每1ml中约含固体总量1mg的溶液,即得多糖参考品贮备液。
多糖参考品溶液 精密量取多糖参考品贮备液,用适宜溶剂稀释制成每1ml中约含100μg的溶液,得多糖参考品工作液。精密量取多糖参考品工作液0、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置于试管中,加适宜溶剂至1.0ml,摇匀,作为多糖参考品溶液。各浓度平行配制两份。
测定法 向多糖参考品溶液各管中缓慢加入0.2%蒽酮-硫酸溶液(称取0.6g蒽酮,加10ml无水乙醇使溶解,然后加入冷却的75%硫酸-生理盐水300ml,充分溶解,混匀;室温贮存,临用配制)4ml,混匀,于沸水浴20分钟,冷却至室温。于620nm波长处读取各管的吸光度值,同时以空白管作为对照。精密量取供试品溶液1.0ml置于试管中,自“缓慢加入0.2%蒽酮-硫酸溶液”起同法操作。以多糖参考品溶液系列浓度(μg/ml)对其相应的吸光度值作直线回归,求得直线回归方程。将供试品溶液的吸光度值代入直线回归方程中,根据稀释倍数计算出供试品的多糖含量。
限度 各型多糖含量应不低于112μg/ml,或应符合批准的要求。
3.4.2.2 1型和5型多糖含量
照“23价肺炎球菌多糖疫苗”3.1.2.6项测定或采用经批准的其他方法测定。
多糖参考品贮备液 精密称定相应型别多糖参考品约50mg,加水10ml使溶解,制成每1ml中约含5mg的溶液,照固体总量测定法(通则3101)测定其固体总量。取该溶液适量,用水定量稀释制成每1ml中约含固体总量1mg的溶液,即得多糖参考品贮备液。
多糖参考品溶液 精密量取多糖参考品贮备液适量,用适宜溶剂定量稀释制成每1ml中约含100μg的溶液,得多糖参考品工作液。精密量取0、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置于试管中,加适宜溶剂至1.0ml,摇匀,作为多糖参考品溶液。各浓度平行配制两份。
测定法 照“23价肺炎球菌多糖疫苗”3.1.2.6项方法测定1型和5型肺炎球菌多糖蛋白结合物中多糖含量。
限度 各型多糖含量应不低于112μg/ml,或应符合批准的要求。
3.4.3 游离多糖含量
采用脱氧胆酸钠沉淀法或其他适宜方法将结合物原液中与蛋白质结合的多糖沉淀或分离,分别照3.4.2项测定沉淀前结合物原液和沉淀后上清液中的多糖含量。3、7F型应不高于10%,1、4、5、6B、9V、14、18C型应不高于15%,6A、19A、19F型应不高于20%,23F型应不高于25%。或应符合批准的要求。
同法检测相应型别多糖对照溶液或衍生物(如有)沉淀前后的多糖含量,分别计算多糖回收率,应为90%~110%。
3.4.4 蛋白质含量
依法测定(通则0731第二法方法1),蛋白质含量应符合批准的要求。
3.4.5 多糖与蛋白质比值
照3.4.2和3.4.4项试验结果计算,多糖与蛋白质比值应符合批准的要求。
3.4.6 分子大小分布测定
采用琼脂糖CL-4B凝胶柱(1.6cm×100cm),依法测定(通则3419第二法)。1、3、4、5、6B、7F、9V、14、18C、19F型肺炎球菌多糖蛋白结合物原液KD值小于等于0.30的回收率应不低于80%;23F型肺炎球菌多糖蛋白结合物原液KD值小于等于0.30的回收率应不低于70%;6A、19A型肺炎球菌多糖蛋白结合物原液KD值小于等于0.30的回收率应不低于60%。或应符合经批准的要求。
3.4.7 游离蛋白含量
照高效液相色谱法(通则0512)或其他适宜方法测定。
色谱条件 用亲水性球形聚甲基丙烯酸酯颗粒或经批准的填充剂;以10mmol/L PBS溶液为流动相;检测波长为214nm;进样体积100μl。
限度 应不高于5.0%。
3.4.8 残留试剂含量
如适用,应采用适宜的方法测定活化、结合或纯化等工艺过程中使用的试剂残留量,并制定适宜的可接受标准。或应符合批准的要求。
3.4.9 无菌检查
依法检查(通则1101),应符合规定。
3.4.10 细菌内毒素检查
依法检查(通则1143),应不高于0.5EU/μg。
3.5 半成品检定
无菌检查 依法检查(通则1101),应符合规定。
3.6 成品检定
3.6.1 外观
振摇后应为白色或乳白色混悬液,无摇不散的凝块,无异物。
3.6.2 检查
3.6.2.1 pH值
依法测定(通则0631),应为5.0~7.0。
3.6.2.2 装量
依法检查(通则0102),应不低于标示量。
3.6.2.3 渗透压摩尔浓度
依法测定(通则0632),应为200~400mOsmol/kg。
3.6.2.4 氯化钠含量
依法测定(通则3107),应为7.5~9.5g/L。
3.6.2.5 铝含量
依法测定(通则3106),应为0.075~0.125mg/剂。
3.6.2.6 聚山梨酯80含量
如添加聚山梨酯80,依法测定(通则3203)或采用经批准的其他方法测定,应符合批准的要求。
3.6.2.7 各型多糖含量
精密量取3ml供试品,加入适宜的解吸附液进行解吸附后,必要时采用适宜稀释液进行进一步稀释,使得供试品溶液中各型别多糖含量在标准曲线的浓度范围内。照“23价肺炎球菌多糖疫苗”3.3.2项方法测定,各型多糖含量应为标示量的70%~130%。
3.6.2.8 各型抗原吸附率
精密量取3ml供试品至离心管中,称取重量W1,8000g离心5分钟,去除上清液,向沉淀中补加稀释液至3ml或向沉淀中补加稀释液至重量为W1(W1±0.03g),混匀,如有必要,8000g再次离心5分钟,去除上清液,向沉淀中补加稀释液至3ml或向沉淀中补加稀释液至重量为W1(W1±0.03g),混匀备用。向上述溶液中加入适宜解吸附液进行解吸附处理,得供试品溶液。必要时采用适宜稀释液进行进一步稀释,使得供试品溶液中各型别多糖含量在标准曲线的浓度范围内。或采用经批准的其他方法制备供试品溶液。
照“23价肺炎球菌多糖疫苗”3.3.2项方法测定。计算各型抗原吸附率,1型≥40%、3型≥40%、4型≥20%、5型≥20%、6A型≥20%、6B型≥40%、7F型≥25%、9V型≥20%、14型≥40%、18C型≥40%、19A型≥40%、19F型≥38%、23F型≥38%,或应符合批准的要求。
3.6.2.9 总蛋白质含量
依法测定(通则0731第二法方法1),应符合批准的要求。
3.6.2.10 蛋白质吸附率
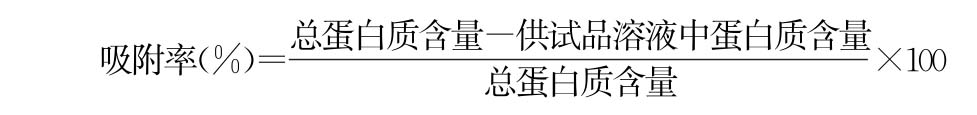
精密量取供试品3ml于离心管中,8000g离心10分钟,收集上清液作为供试品溶液;或弃去上清后,向沉淀中加入氯化钠注射液至3ml,作为供试品溶液。依法测定供试品溶液中蛋白质浓度(通则0731第二法方法1),按下式计算供试品中的蛋白质吸附率,应不低于70%。
当供试品溶液为上清液时:
当供试品溶液为沉淀溶液:

3.6.2.11 无菌检查
依法检查(通则1101),应符合规定。
3.6.2.12 异常毒性检查
依法检查(通则1141),应符合规定。注射剂量为每只小鼠0.5ml,含1次人用剂量;每只豚鼠5ml,含10次人用剂量。
3.6.2.13 细菌内毒素检查
依法检查(通则1143),应小于10EU/剂。
4 保存、运输及有效期
于2~8℃保存和运输。自生产之日起,有效期不超过24个月或符合批准的要求。
5 使用说明
应符合生物制品分包装和贮运管理(通则0239)规定和批准的内容。
(c)蒲标网 - 中国药典、药品标准、法规在线查询 ( 津ICP备15007510号 )


