
1431 生物检定统计法
一、总则
生物检定法是利用生物体包括整体动物、离体组织、器官、细胞和微生物等评估药物生物活性的一种方法。它以药物的药理作用为基础,以生物统计为工具,运用特定的实验设计在一定条件下比较供试品和与其相当的标准品或对照品所产生的特定反应,通过等反应剂量间比例的运算或限值剂量引起的生物反应程度,从而测定供试品的效价、生物活性或杂质引起的毒性。
生物检定统计法主要叙述应用生物检定时必须注意的基本原则、一般要求、实验设计及统计方法。有关品种用生物检定的具体实验条件和要求,必须按照该品种生物检定法项下的规定。
生物检定标准品 凡中国药典规定用生物检定的品种都有其生物检定标准品(S)。S都有标示效价,以效价单位(u)表示,其含义和相应国际标准品的效价单位一致。
供试品 供试品(T或U)是供检定其效价的样品,它的活性组分应与标准品基本相同。
AT或AU是T或U的标示量或估计效价。
等反应剂量对比 生物检定是将T和其S在相同的实验条件下同时对生物体或其离体器官组织等的作用进行比较,通过对比,计算出它们的等反应剂量比值(R),以测得T的效价PT。
R是S和T等反应剂量(dS、dT)的比值,即R=dS/dT。
M是S和T的对数等反应剂量(xS、xT)之差,即M=lgdS-lgdT=xS-xT。R=antilgM。
PT是通过检定测得T的效价含量,称T的测得效价,是将效价比值(R)用T的标示量或估计效价AT校正之后而得,即PT=AT·R或PT=AT·antilgM。
检定时,S按标示效价计算剂量,T按标示量或估计效价(AT)计算剂量,注意调节T的剂量或调整其标示量或估计效价,使S和T的相应剂量组所致的反应程度相近。
生物变异的控制 生物检定具有一定的实验误差,其主要来源是生物变异性。因此生物检定必须注意控制生物变异,或减少生物变异本身,或用适宜的实验设计来减小生物变异对实验结果的影响,以减小实验误差。控制生物变异必须注意以下几点:
(1)生物来源、饲养或培养条件必须均一。
(2)对影响实验误差的条件和因子,在实验设计时应尽可能作为因级限制,将选取的因级随机分配至各组。例如体重、性别、窝别、双碟和给药次序等都是因子,不同体重是体重因子的级,雌性、雄性是性别因子的级,不同窝的动物是窝别因子的级,不同双碟是碟间因子的级,给药先后是次序因子的级等。按程度划分的级(如动物体重),在选级时,应选动物较多的邻近几级,不要间隔跳越选级。
(3)按实验设计类型的要求将限制的因级分组时,也必须严格遵守随机的原则。
误差项 指从实验结果的总变异中分去不同剂量及不同因级对变异的影响后,剩余的变异成分,用方差(s2)表示。对于因实验设计类型的限制无法分离的变异成分,或估计某种因级对变异的影响小,可不予分离者,都并入s2。但剂间变异必须分离。
误差项的大小影响标准误SM和可信限(4)(FL)。
不同的检定方法和实验设计类型,分别按有关的公式计算s2。
可靠性测验 要求在实验所用的剂量范围内,剂量或对数剂量的反应(或反应的函数)符合特定模型要求,且标准品与供试品的相似性满足计算原理的要求,即满足系统适用性和样品适用性要求,方可按有关公式计算供试品的效价和可信限。如:
平行(直)线模型要求其在所用剂量范围内,对数剂量与反应(或反应的函数)呈直线关系,供试品和标准品的直线满足平行性要求;
四参数模型要求其在所用剂量范围内,对数剂量与反应(或反应的函数)呈S曲线形关系,供试品和标准品的S形曲线平行;
质反应资料要求其在所用剂量范围内,对数剂量与反应(或反应的函数)呈广义线性关系,供试品和标准品呈线性平行。
方法的可靠性测验(适用性评估)可以使用差异性检验,也可使用等效性检验进行评估。等效性检验的等效区间需提供科学依据。
对线性模型的评估,除可使用“二次曲线”和“反向二次曲线”的评估外,也可使用其他的“偏离线性”评估。
可信限和可信限率 可信限(FL)标志检定结果的精密度。M的可信限是M的标准误SM和t值的乘积(t·SM),用95%的概率水平。M+t·SM是可信限的高限;M-t·SM是可信限的低限。用其反对数计算得R和PT的可信限低限及高限,是在95%的概率水平下从样品的检定结果估计其真实结果的所在范围。
R或PT的可信限率(FL%)是用R或PT的可信限计算而得,为可信限的高限与低限之差除以2倍效价均值后的比值。

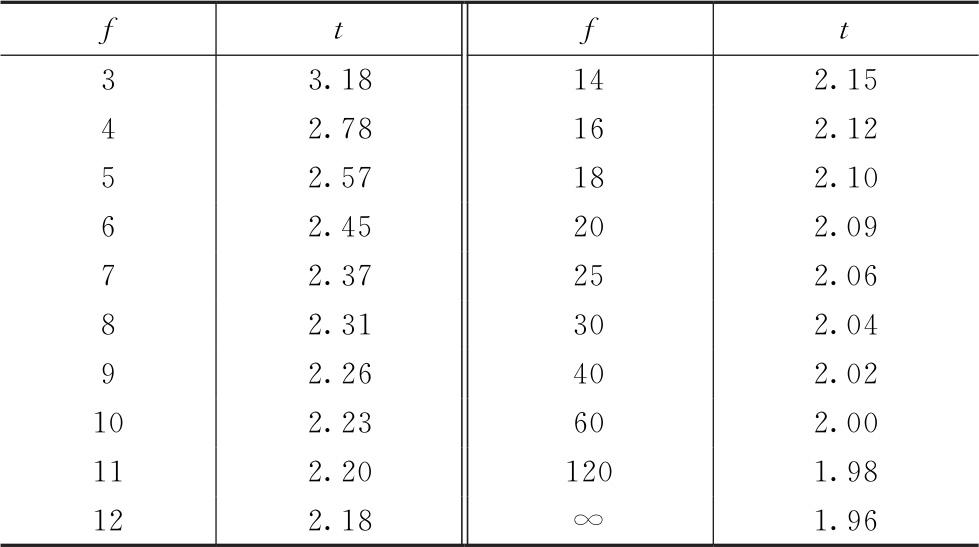
计算可信限的t值是根据s2的自由度(f)查t值表而得。t值与f的关系见表一。
表一 自由度(f)及对应的双侧t值(P=0.95)
各品种的检定方法项下都有其可信限率的规定,如果检定结果不符合规定,可缩小动物体重范围或年龄范围等生物样本间的差异,或调整对供试品的估计效价或调节剂量,重复实验以减小可信限率。
对同批供试品重复试验所得n次实验结果(包括FL%超过规定的结果),可按实验结果的合并计算法算得PT的均值及其FL%作为检定结果。
二、直接测定法
直接测得药物对各个动物最小效量或最小致死量的检定方法。如洋地黄及其制剂的效价测定。
xS和xT为S和T组各只动物的对数最小致死量,它们的均值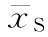 和
和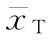 为S和T组的等反应剂量,nS和nT为S和T组的动物数。
为S和T组的等反应剂量,nS和nT为S和T组的动物数。
1.效价计算
按(1)~(3)式计算M、R和PT。

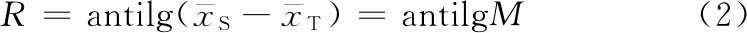

2.误差项及可信限计算
按(4)~(8)式计算s2、SM及R或PT的FL和FL%。
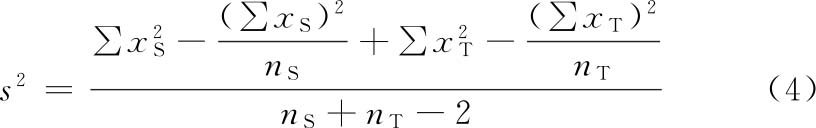
f=nS+nT-2,用此自由度查表一得t值。
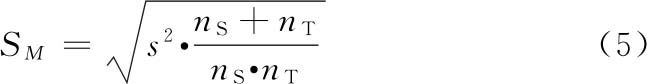
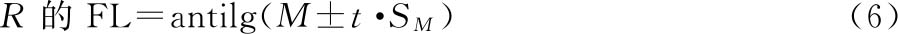
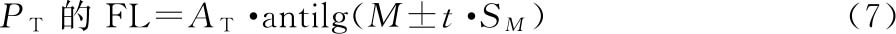

当两批以上供试品(T、U…)和标准品同时比较时,按(9)式计算S、T、U的合并方差s2。
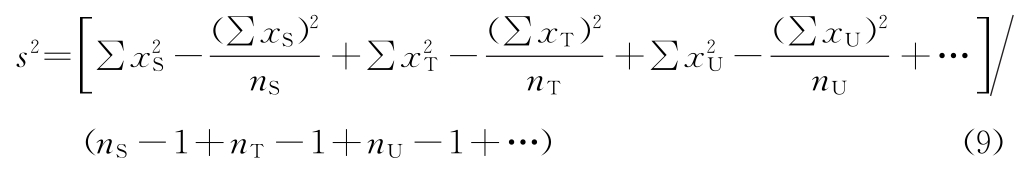
f=nS-1+nT-1+nU-1+…
效价PT、PU…则是T、U分别与S比较,按(1)~(3)式计算。
3.实例
例1 直接测定法
洋地黄效价测定——鸽最小致死量(MLD)法
S为洋地黄标准品,按标示效价配成1.0u/ml的酊剂,临试验前稀释25倍。
T为洋地黄叶粉,估计效价AT=10u/g,配成1.0u/ml的酊剂,临试验前配成稀释液(1→25)。测定结果见表1-1。
表1-1 洋地黄效价测定结果
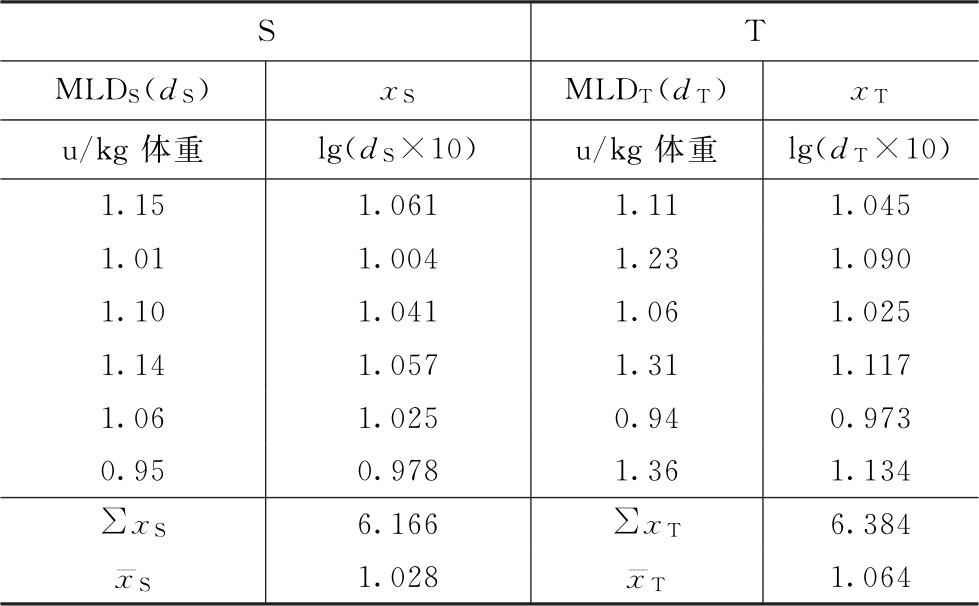
按(1)~(3)式:
M=1.028-1.064=-0.036
R=antilg(-0.036)=0.9204
PT=10×0.9204=9.20(u/g)
按(4)~(8)式计算s2、SM、PT的FL和FL%。

三、量反应平行线测定法
药物对生物体所引起的反应随着药物剂量的增加产生的量变可以测量者,称量反应。量反应检定用平行线测定法,要求在一定剂量范围内,S和T的对数剂量x和反应或反应的特定函数y呈直线关系,当S和T的活性组分基本相同时,两直线平行。量反应模型的原理见图1。
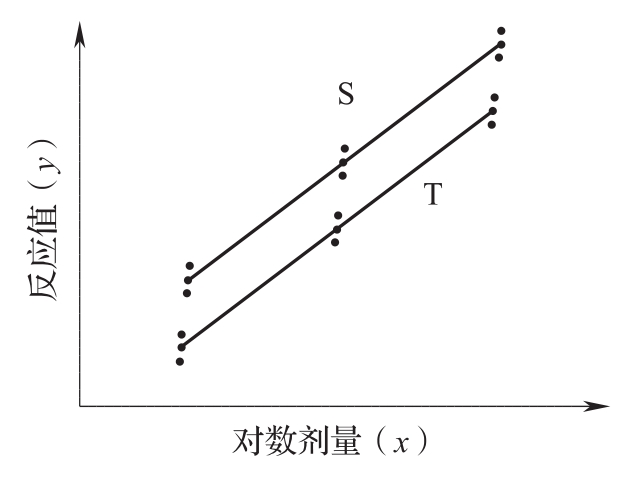
图1 (3.3)剂量组的平行线模型
本版药典量反应检定主要用(2.2)法、(3.3)法、(4.4)法或(2.2.2)法、(3.3.3)法、(4.4.4)法,即S、T(或U)各设2个、3个或4个剂量组,统称(k·k)法或(k·k·k)法;如果S和T的剂量组数不相等,则称(k·k')法;前面的k代表S的剂量组数,后面的k或k'代表T的剂量组数。一般都是按(k·k)法实验设计,当S或T的端剂量所致的反应未达阈值,或趋于极限,去除此端剂量后,对数剂量和反应的直线关系成立,这就形成了(k·k')法。例如(3.3)法设计就可能形成(2.3)法或(3.2)法等。因此,(k·k')法中的k只可能比k'多一组或少一组剂量。(k·k')法的计算结果可供重复试验时调节剂量或调整供试品估计效价时参考。无论是(k·k)法、(k·k')法或(k·k·k)法,都以K代表S和T的剂量组数之和,故K=k+k或K=k+k'或K=k+k+k。
本版药典平行线测定法的计算都用简算法,因此对各种(k·k)法要求:
(1)S和T相邻高低剂量组的比值(r)要相等,一般r用(1∶0.8)~(1∶0.5),设lgr=I。
(2)各剂量组的反应个数(m)应相等。
1.平行线测定的实验设计类型
根据不同的检定方法可加以限制的因级数采用不同的实验设计类型。本版药典主要用下面三种实验设计类型。
(1)随机设计 剂量组内不加因级限制,有关因子的各级随机分配到各剂量组。本设计类型的实验结果只能分离不同剂量(剂间)所致变异,如绒促性素的生物检定。
(2)随机区组设计 将实验动物或实验对象分成区组,一个区组可以是一窝动物、一只双碟或一次实验。在剂量组内的各行间加以区组间(如窝间、碟间、实验次序间)的因级限制。随机区组设计要求每一区组的容量(如每一窝动物的受试动物只数、每一只双碟能容纳的小杯数等)必须和剂量组数相同,这样可以使每一窝动物或每一只双碟都能接受到各个不同的剂量。因此随机区组设计除了从总变异中分离剂间变异之外,还可以分离区组间变异,减小实验误差。例如抗生素杯碟法效价测定。
(3)交叉设计 同一动物或实验对象可以分两次进行实验者适合用交叉设计。交叉设计中,各组的受试动物或实验对象数量应相等。标准品(S)和供试品(T)对比时,一组动物在第一次试验时接受S的一个剂量,第二次试验时则接受T的一个剂量,如此调换交叉进行,可以在同一动物身上进行不同试品、不同剂量的比较,以去除动物间差异对实验误差的影响,提高实验精确度,节约实验动物。
(2.2)法S和T各两组剂量,用双交叉设计,将动物分成四组;对各组中的每一只动物都标上识别号。每一只动物都按给药次序表进行两次实验。
双交叉设计两次实验的给药次序表

2.平行线测定法的方差分析和可靠性测验
随机设计和随机区组设计的方差分析和可靠性测验
(1)将反应值或其规定的函数(y)按S和T的剂量分组列成方阵表 见表二。
表二 平行线模型中的剂量分组方阵表
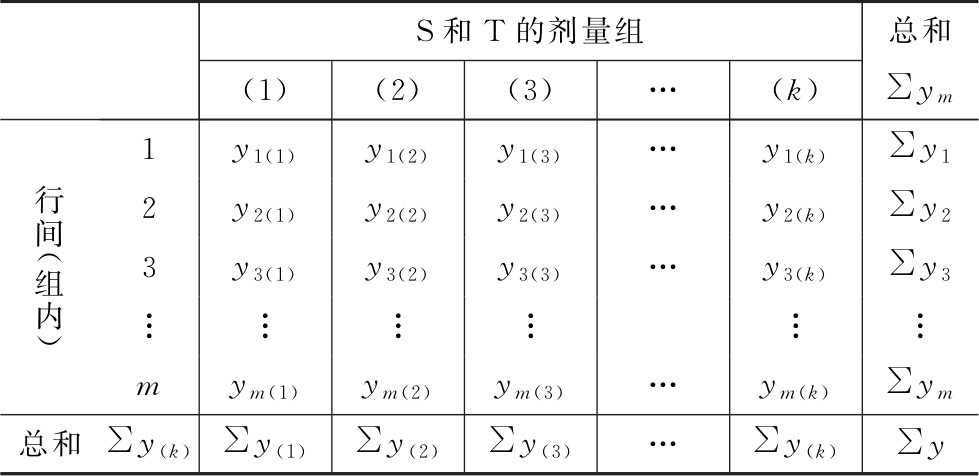
方阵中,K为S和T的剂量组数和,m为各剂量组内y的个数,如为随机区组设计,m为行间或组内所加的因级限制;n为反应的总个数,n=mK。
(2)异常值剔除和缺项补足
异常值剔除 在同一剂量组内的各个反应值中,如出现特大或特小的反应值时,应进行异常值检验,以确定其是否应被剔除。检验异常值的方法很多,建议根据样本量大小选择使用狄克森(Dixon)检验法或格拉布斯(Grubbs)检验法。
方法1 狄克森(Dixon)检验法
该法仅适于同组中反应值较少时,对其中可疑的异常反应值进行检验。该法假定在99%的置信水平下,一个有效的反应值被拒绝的概率仅有1%(异常值出现在单侧)。
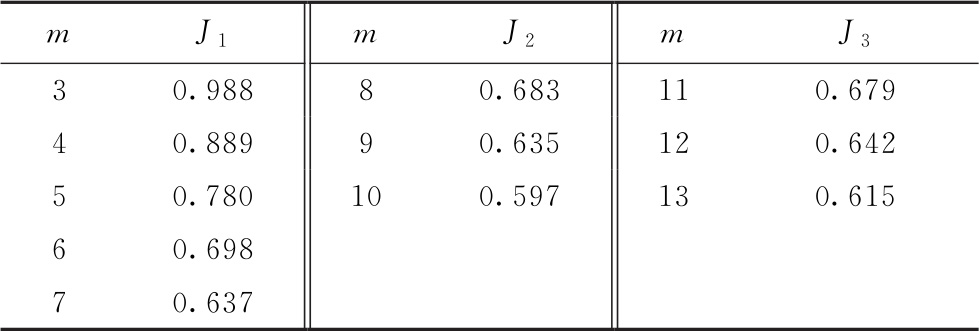
假定有同一组中m个观测反应值,按照由小到大的顺序进行排列,y1…ym。按表三中的公式对组内可疑的异常反应值计算J值。
表三 狄克森检验法异常值的J1、J2和J3计算公式

如果J1、J2或J3中的计算值超出表四中给出的标准值,则判断为异常值,可考虑剔除。当同一组中的观察反应值数目大于13个时,请选用方法2。
对一个正态反应的样本,在99%置信水平下,差距不小于表四中J1、J2或J3的值时,其异常值出现在任一侧的概率P=0.01。
表四 P < 0 . 0 1 时狄克森检验法异常值判断标准
方法2 格拉布斯(Grubbs)检验法
该法既可用于同组反应值中的异常值检验,也可用于具有方差同质时的模型(如直线性模型或非直线性模型)中的残差法检测异常值。本法的计算原理如下。
找出本组数据中离样本均值最大的值yi,计算其标准化偏离值Z:

式中 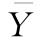 和S分别是该组数据的均值和标准差。对于使用平行线模型计算得到的残差,则
和S分别是该组数据的均值和标准差。对于使用平行线模型计算得到的残差,则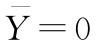 ;S是试验中的残差均值的平方根,即均方根误差。当|Z|大于使用下列公式得到的G值时,则认为yi值属于99%置信水平下的一个统计异常值。
;S是试验中的残差均值的平方根,即均方根误差。当|Z|大于使用下列公式得到的G值时,则认为yi值属于99%置信水平下的一个统计异常值。
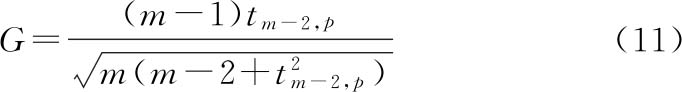
式中 m为本组数据的样本量;
t为在m-2自由度水平下,具有S标准偏差的t分布中100p%的单侧值。

缺项补足 因反应值被剔除或因故反应值缺失造成缺项,致m不等时,可根据实验设计类型做缺项补足,使各剂量组的反应个数m相等。
随机设计 对缺失数据的剂量组,以该组的反应均值补入,缺1个反应补1个均值,缺2个反应补2个均值。
随机区组设计 按(13)式计算的值,补足缺项。
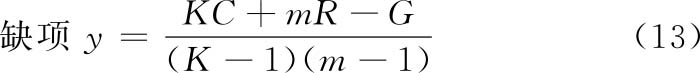
式中 C为扣除缺项/异常值后所在列(剂量组)内的反应值总和;
R为扣除缺项/异常值后所在行(区组/动物数)内的反应值总和;
G为扣除缺项/异常值后所有反应值总和;
K为S和T的剂量组之和;
m为各剂量组内反应值数目或动物数。
如果缺1项以上,可以分别以y1、y2、y3等代表各缺项,然后在计算其中之一时,把其他缺项y直接用符号y1、y2等当作未缺项代入(13)式,这样可得与缺项数相同的方程组,解方程组即得。
随机区组设计,当剂量组内安排的区组数较多时,也可将缺项所在的整个区组除去。
随机设计的实验结果中,如在个别剂量组多出1~2个反应值,可按严格的随机原则去除,使各剂量组的反应个数m相等。
不论哪种实验设计,每补足一个缺项,就需把s2的自由度减去1,缺项不得超过反应总个数的5%。
(3)方差分析 方阵表(表二)的实验结果,按(14)~(21)式计算各项变异的差方和、自由度(f)及误差项的方差(s2)。
随机设计 按(14)式、(15)式计算差方和(总)、差方和(剂间)。按(20)式计算差方和(误差)。按(18)式或(21)式计算s2。
随机区组设计 按(14)~(17)式计算差方和(总)、差方和(剂间)、差方和(区组间)、差方和(误差)。按(18)式或(19)式计算s2。
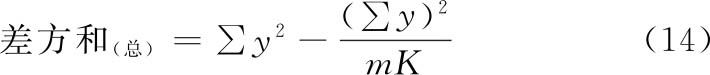
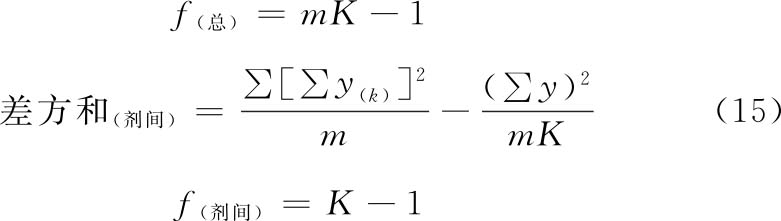
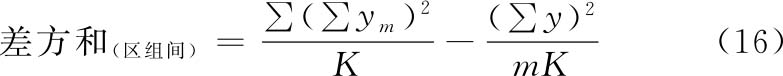


或
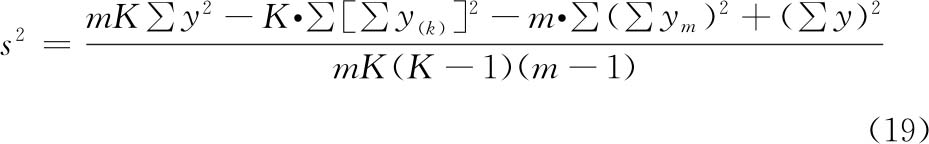
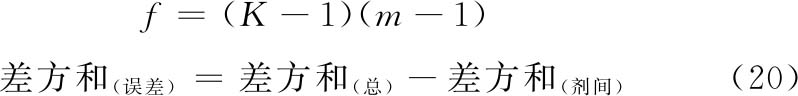
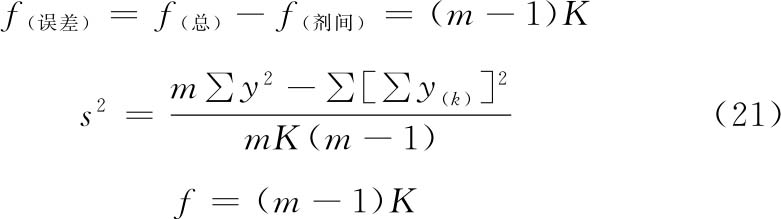
(4)可靠性测验 通过对剂间变异的分析,以测验S和T的对数剂量和反应的关系是否显著偏离平行直线。(2.2)法和(2.2.2)法的剂间变异分析为试品间、回归、偏离平行三项,其他(k·k)法还需再分析二次曲线、反向二次曲线等。
可靠性测验的剂间变异分析
(k·k)法、(k·k')法按表五计算各变异项的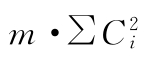 及∑[Ci·∑y(k)],按(22)式计算各项变异的差方和。
及∑[Ci·∑y(k)],按(22)式计算各项变异的差方和。
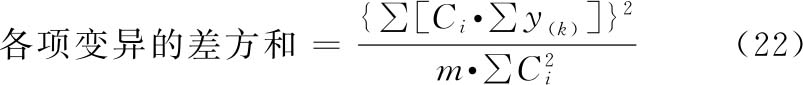
f=1
(k·k·k)法按(23)式、(24)式计算试品间差方和。
(2.2.2)法
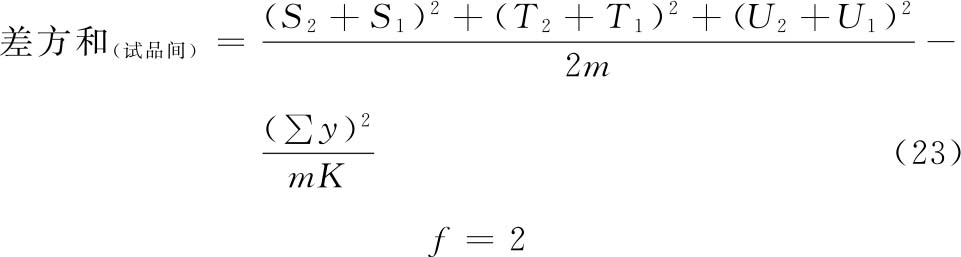
(3.3.3)法
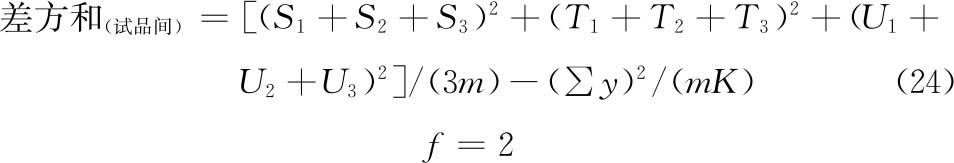
按表六计算回归、二次曲线、反向二次曲线各项变异的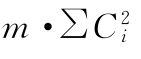 及∑[Ci·∑y(k)];按(22)式计算差方和(回归)、差方和(二次曲线)。
及∑[Ci·∑y(k)];按(22)式计算差方和(回归)、差方和(二次曲线)。
表五 (k·k)法、(k·k')法可靠性测验正交多项系数表
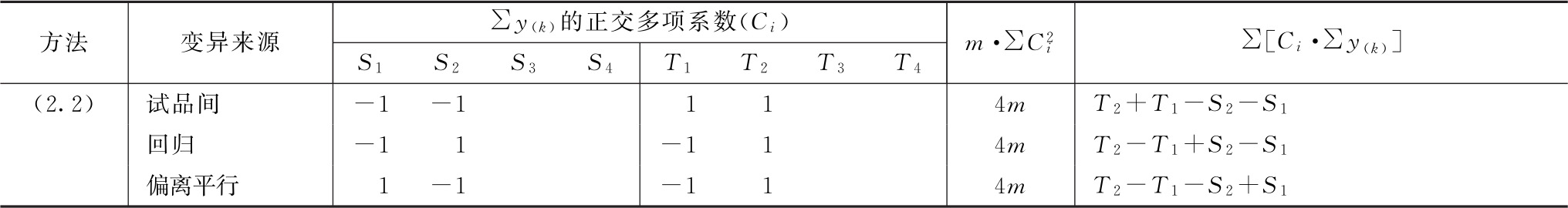
续表
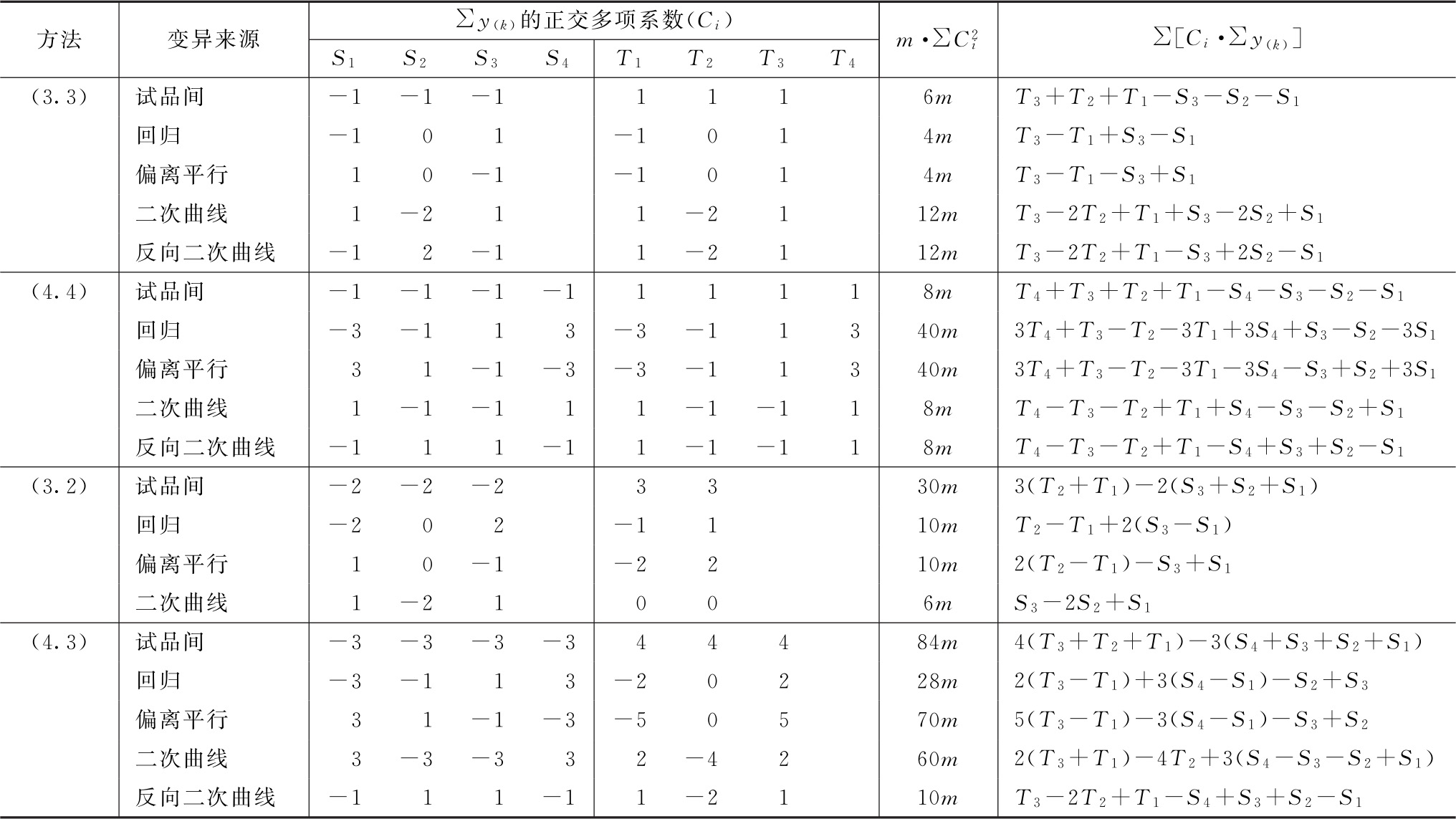
注:用(2.3)法及(3.4)法时,分别将(3.2)法及(4.3)法中S和T的正交多项系数互换即得。
表中S1、S2…T1、T2…在量反应分别为标准品和供试品每一剂量组内的反应值或它们规定函数的总和[相当于表二的∑y(k)各项]。所有脚序1、2、3……都是顺次由小剂量到大剂量,Ci是与之相应的正交多项系数。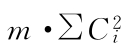 是该项变异各正交多项系数的平方之和与m的乘积,∑[Ci·∑y(k)]为S1、S2…T1、T2…分别与该项正交多项系数乘积之和。
是该项变异各正交多项系数的平方之和与m的乘积,∑[Ci·∑y(k)]为S1、S2…T1、T2…分别与该项正交多项系数乘积之和。
表六 (k·k·k)法可靠性测验正交多项系数表
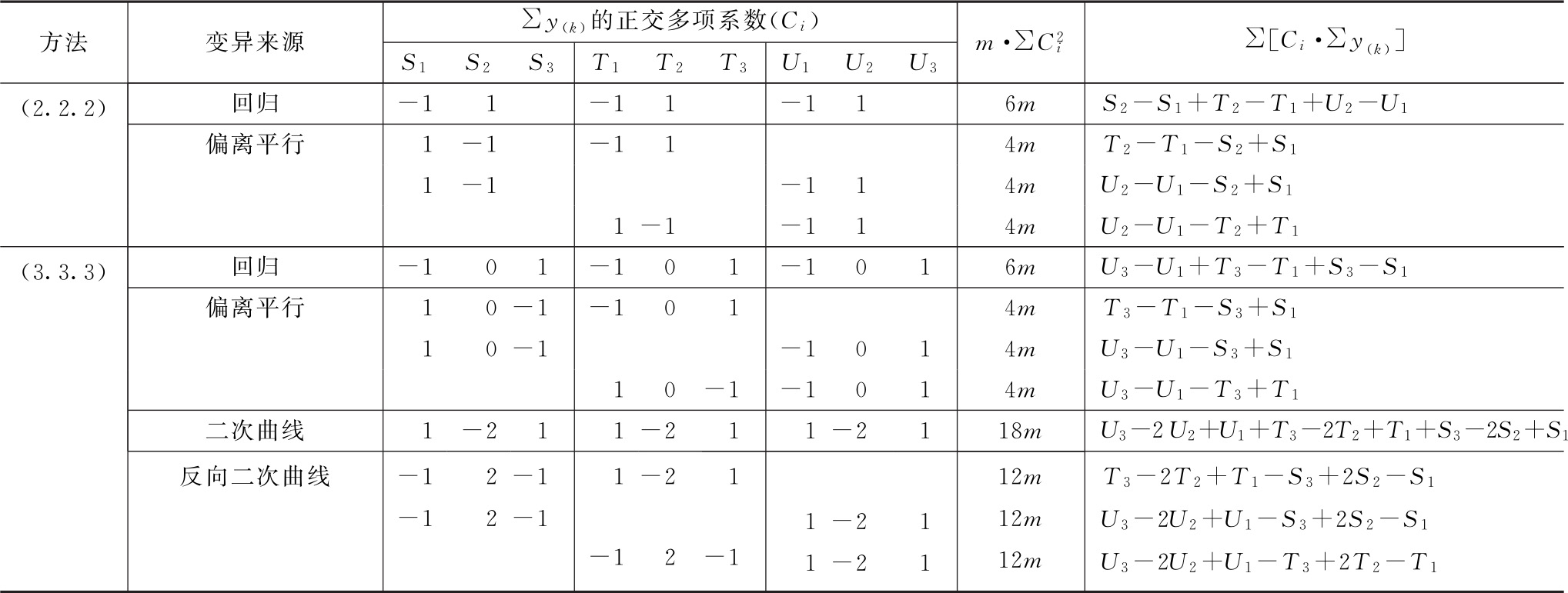
按(25)式计算差方和(偏离平行)及差方和(反向二次曲线)。

f=2
按(18)式计算各项变异的方差。
将方差分析结果列表进行可靠性测验。例如随机区组设计(3.3)法可靠性测验结果列表,见表七。
表七 随机区组设计(3.3)法可靠性测验结果
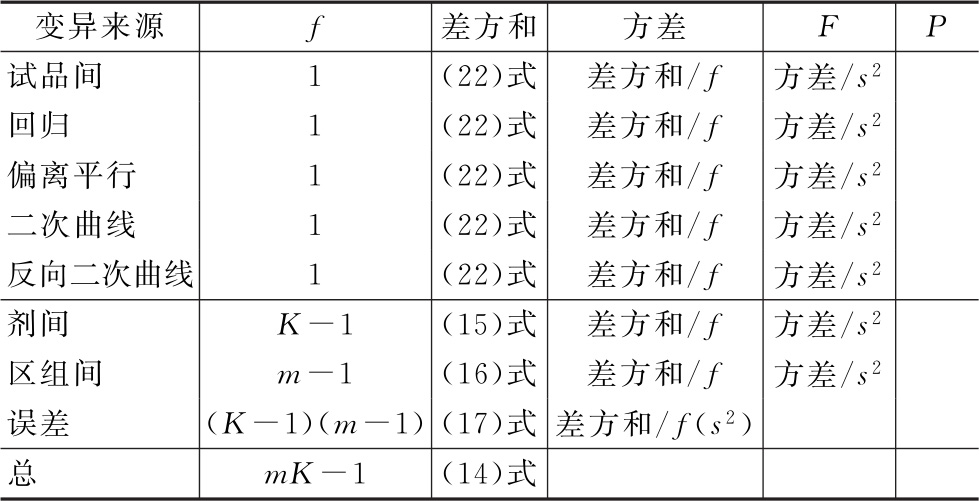
表七中概率P是以该变异项的自由度为分子,误差项(s2)的自由度为分母,查F值表(表八),将查表所得F值与表七F项下的计算值比较而得。当F计算值大于P=0.05或P=0.01的查表值时,则P<0.05或P<0.01,即为在此概率水平下该项变异有显著意义。
随机设计没有区组间变异项。
可靠性测验结果判断
可靠性测验结果,回归项应非常显著(P<0.01)。
(2.2)法、(2.2.2)法偏离平行应不显著(P>0.05)。
其他(k·k)法、(k·k·k)法偏离平行、二次曲线、反向二次曲线或偏离线性各项均应不显著(P>0.05)。
试品间一项不作为可靠性测验的判断标准,试品间变异非常显著者,重复试验时,应参考所得结果重新估计T的效价或重新调整剂量试验。
双交叉设计的方差分析和可靠性测验
(1)双交叉设计实验结果的方阵表 将动物按体重随机分成四组,各组的动物数(m)相等,四组的动物总数为4m。对四组中的每一只动物都加以识别标记,按双交叉设计给药次序表进行实验,各组的每一只动物都给药两次,共得2×4m个反应值。将S、T各两个剂量组两次实验所得反应值排列成表,见表九。
表八 F值表
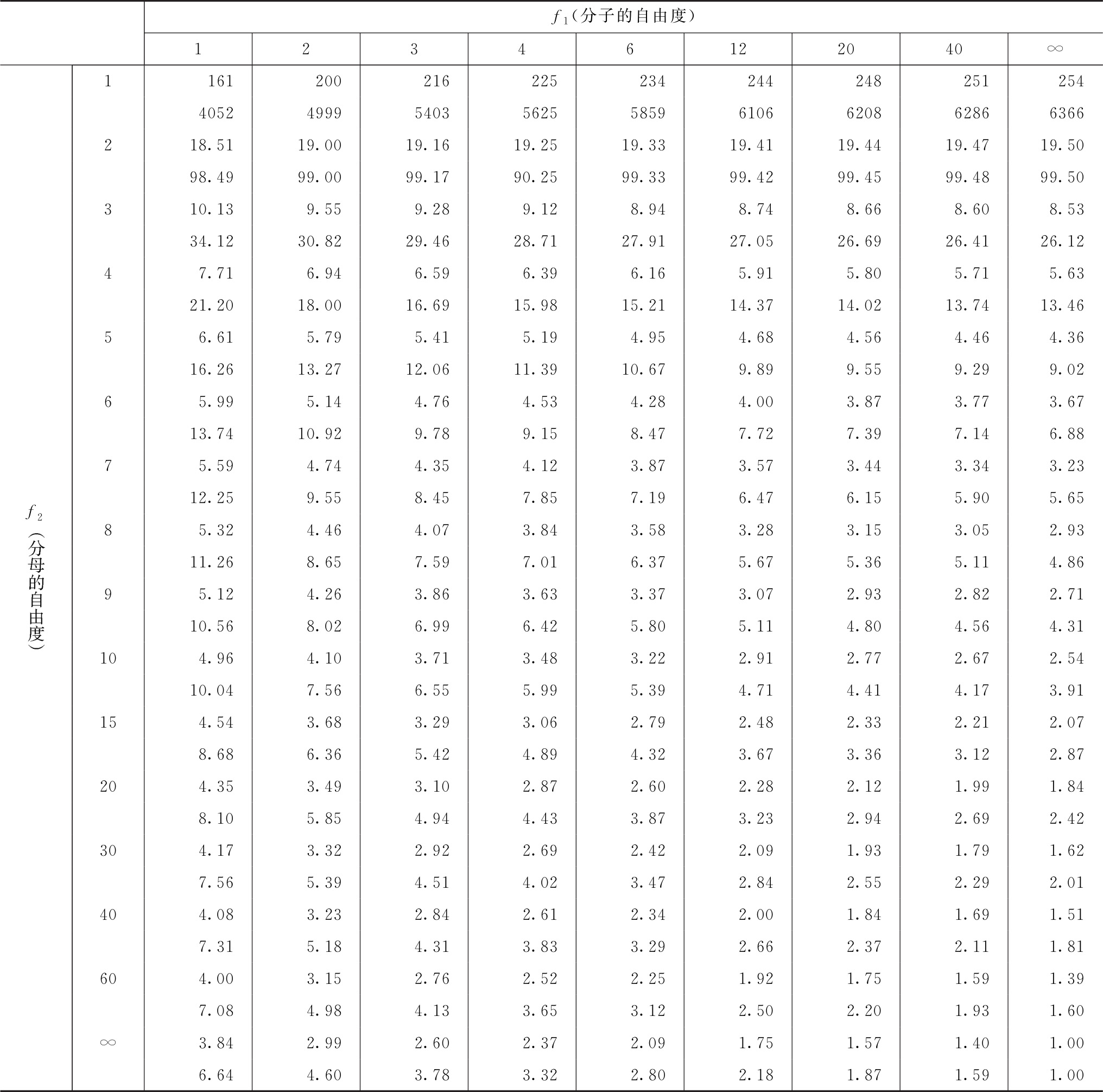
注:上行,P=0.05;下行,P=0.01。
表九 双交叉实验结果
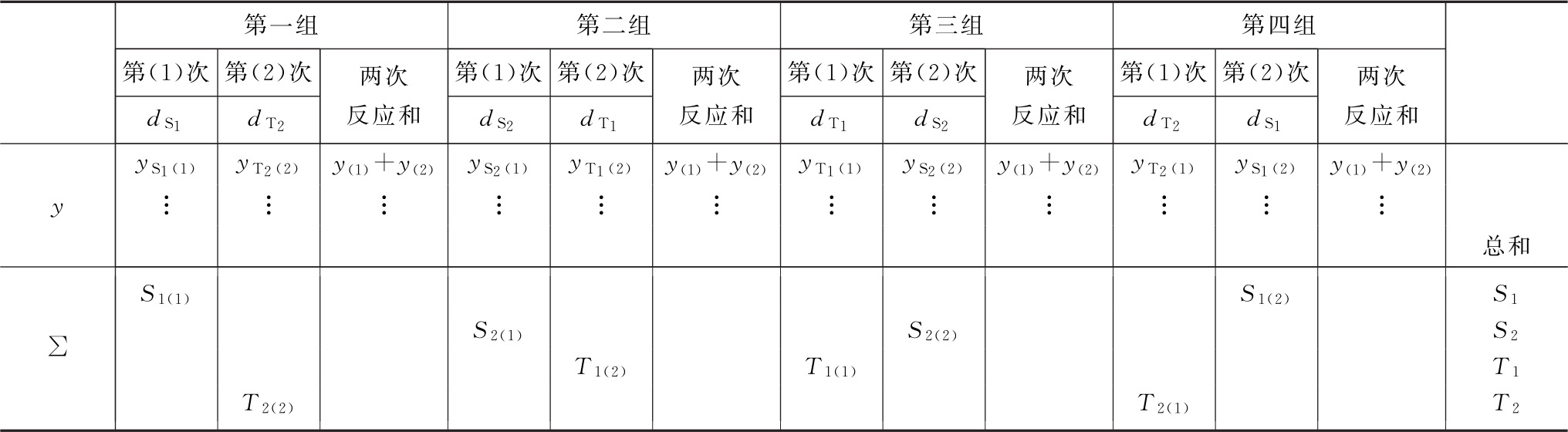
(2)缺项补足 表九中如有个别组的1个反应值因故缺失,均作该只动物缺失处理,在组内形成两个缺项。此时,可分别用两次实验中该组动物其余各反应值的均值补入;也可在其余三组内用严格随机的方法各去除1只动物,使各组的动物数相等。每补足一个缺项,误差(Ⅰ)和误差(Ⅱ)的方差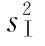 和
和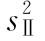 的自由度都要减去1。缺项不得超过反应总个数的5%。同一组内缺失的动物不得超过1只。
的自由度都要减去1。缺项不得超过反应总个数的5%。同一组内缺失的动物不得超过1只。
(3)方差分析 双交叉设计的总变异中,包含有动物间变异和动物内变异。对表九的2×4m个反应值进行方差分析时,总变异的差方和(总)按(26)式计算。
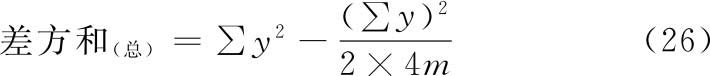
f(总)=2×4m-1
动物间变异是每一只动物两次实验所得反应值的和(表九每组动物的第三列)之间的变异,其差方和按(27)式计算。
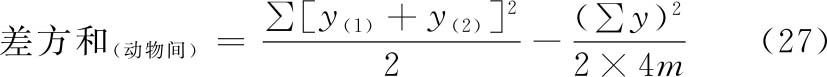
f(动物间)=4m-1
总变异中分除动物间变异,余下为动物内变异。
动物间变异和动物内变异的分析 将表九中S和T各剂量组第(1)次实验所得反应值之和S1(1)、S2(1)、T1(1)、T2(1)及第(2)次实验反应值之和S1(2)、S2(2)、T1(2)、T2(2)按表十双交叉设计正交系数表计算各项变异的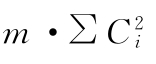 及∑(Ci·∑y),按(22)式计算各项变异的差方和。
及∑(Ci·∑y),按(22)式计算各项变异的差方和。
总变异的差方和减去动物间变异的差方和,再减去动物内各项变异的差方和,余项为误差(Ⅰ)的差方和,按(28)式计算。

f(误差Ⅰ)=f(总)-f(动物间)-f(试品间)-f(回归)-f(次间)-f(次间×偏离平行)=4(m-1)
误差(Ⅰ)的方差s2,用以计算实验误差SM、FL及进行动物内各项变异(表十中有*标记者)的F测验。
表十 双交叉设计正交系数表①
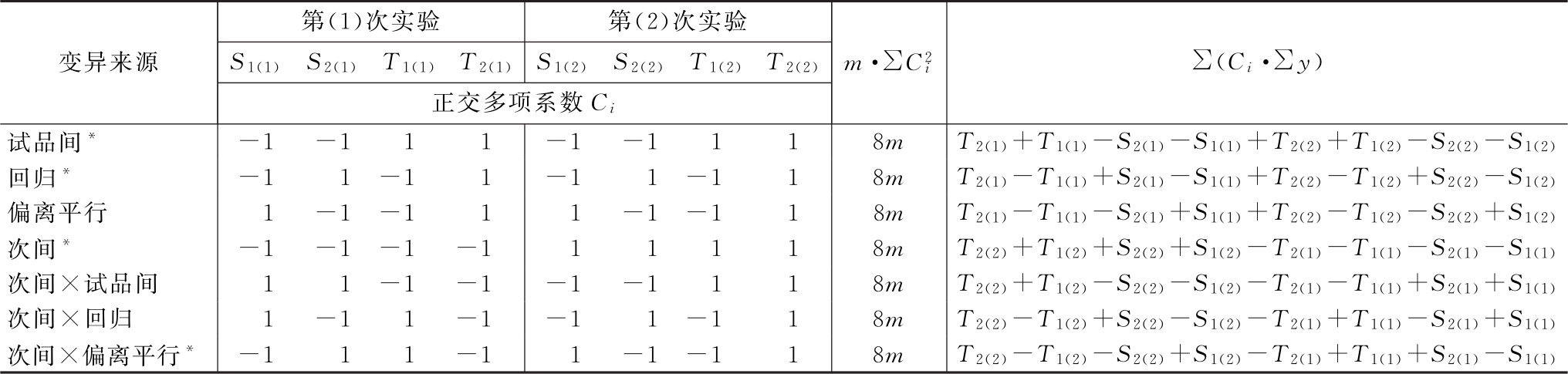
注:①各项变异的自由度均为1。有*号标记的四项为动物内变异,其余三项为动物间变异。
误差(Ⅱ)的差方和为动物间变异的差方和减去表十中其余三项变异(表十中无*标记者)的差方和,按(29)式计算。


误差(Ⅱ)的方差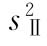 用以进行上述三项变异的F测验。
用以进行上述三项变异的F测验。
(4)可靠性测验 将方差分析及F测验的结果列表,如表十一。
表十一中的概率P,计算同表七,但表的上半部分是以 的自由度为分母,表的下半部分以s2的自由度为分母,查F值表(表八),将查表所得的F值与表十一F项下的计算值比较而得。
的自由度为分母,表的下半部分以s2的自由度为分母,查F值表(表八),将查表所得的F值与表十一F项下的计算值比较而得。
表十一 双交叉设计可靠性测验结果
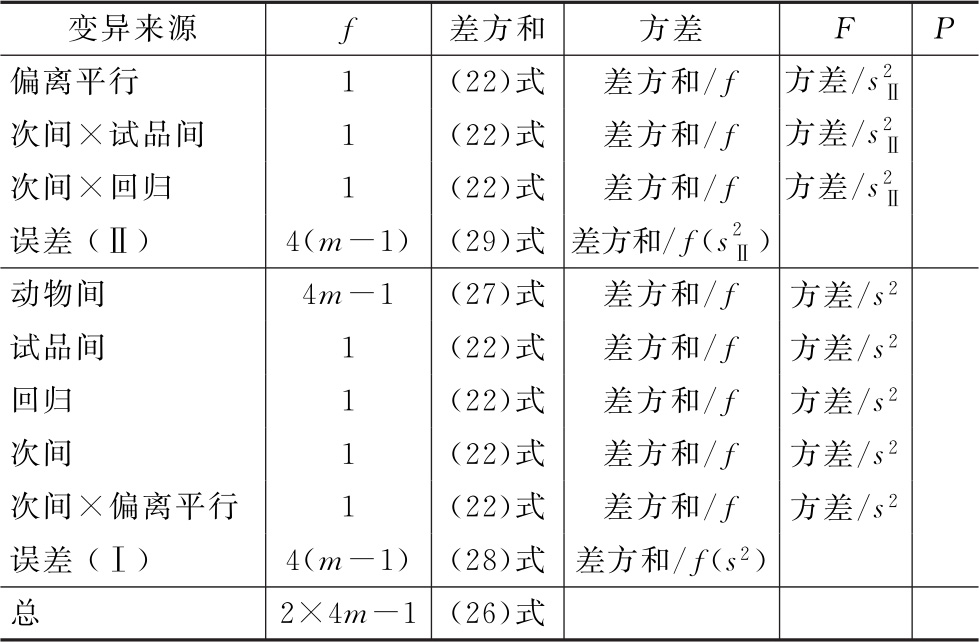
可靠性测验结果判断 回归、偏离平行、试品间三项的判断标准同(2.2)法。
次间×试品间、次间×回归、次间×偏离平行三项中,如有F测验非常显著者,说明该项变异在第一次和第二次实验的结果有非常显著的差别,对出现这种情况的检定结果,下结论时应慎重,最好复试。
3.效价(PT)及可信限(FL)计算
各种(k·k)法都按表十二计算V、W、D、A、B、g等数值,代入(30)~(33)式及(3)式、(8)式计算R、PT、SM以及R、PT的FL和FL%等。

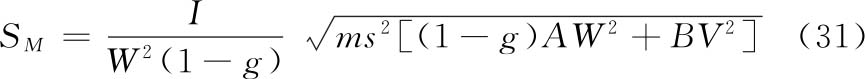
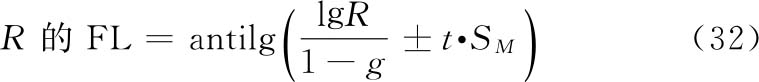
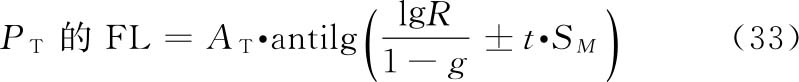
(2.2)法双交叉设计 计算方法同上述(2.2)法。双交叉设计各剂量组都进行两次试验,S和T每一剂量组的反应值个数为组内动物数的两倍(2m)。
(1)双交叉设计用S和T各组剂量两次试验所得各反应值之和(表九中的S1、S2、T1、T2)按表十二(2.2)法公式计算V、W、D数值。
(2)参照(3 1)式计算SM,因每只动物进行两次实验,式中m用2m代替,(2.2)法A=1,B=1,SM的公式为:
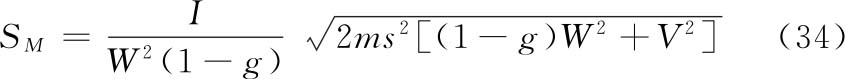
式中 s2为表十一中误差(Ⅰ)的方差;
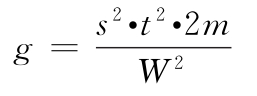
表十二 量反应平行线检定法的计算公式①
注:①表中dS、dT分别为S和T的剂量,下角1、2、3是顺次由小剂量到大剂量。
4.实例
例2 量反应平行线测定随机设计(3.3.3)法
绒促性素(HCG)效价测定——小鼠子宫法
S为绒促性素标准品
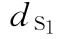 :0.135u/鼠
:0.135u/鼠 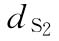 :0.225u/鼠
:0.225u/鼠 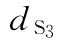 :0.375u/鼠
:0.375u/鼠
T为绒促性素 估计效价AT:2500u/mg
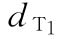 :0.135u/鼠
:0.135u/鼠 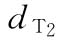 :0.225u/鼠
:0.225u/鼠 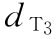 :0.375u/鼠
:0.375u/鼠
U为绒促性素粉针,标示量AU:500u/安瓿
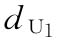 :0.144u/鼠
:0.144u/鼠 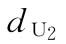 :0.240u/鼠
:0.240u/鼠 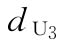 :0.400u/鼠
:0.400u/鼠
r=1∶0.6 I=0.222
反应(y):10g体重的子宫重(mg)
测定结果见表2-1。
表2-1 HCG效价测定结果
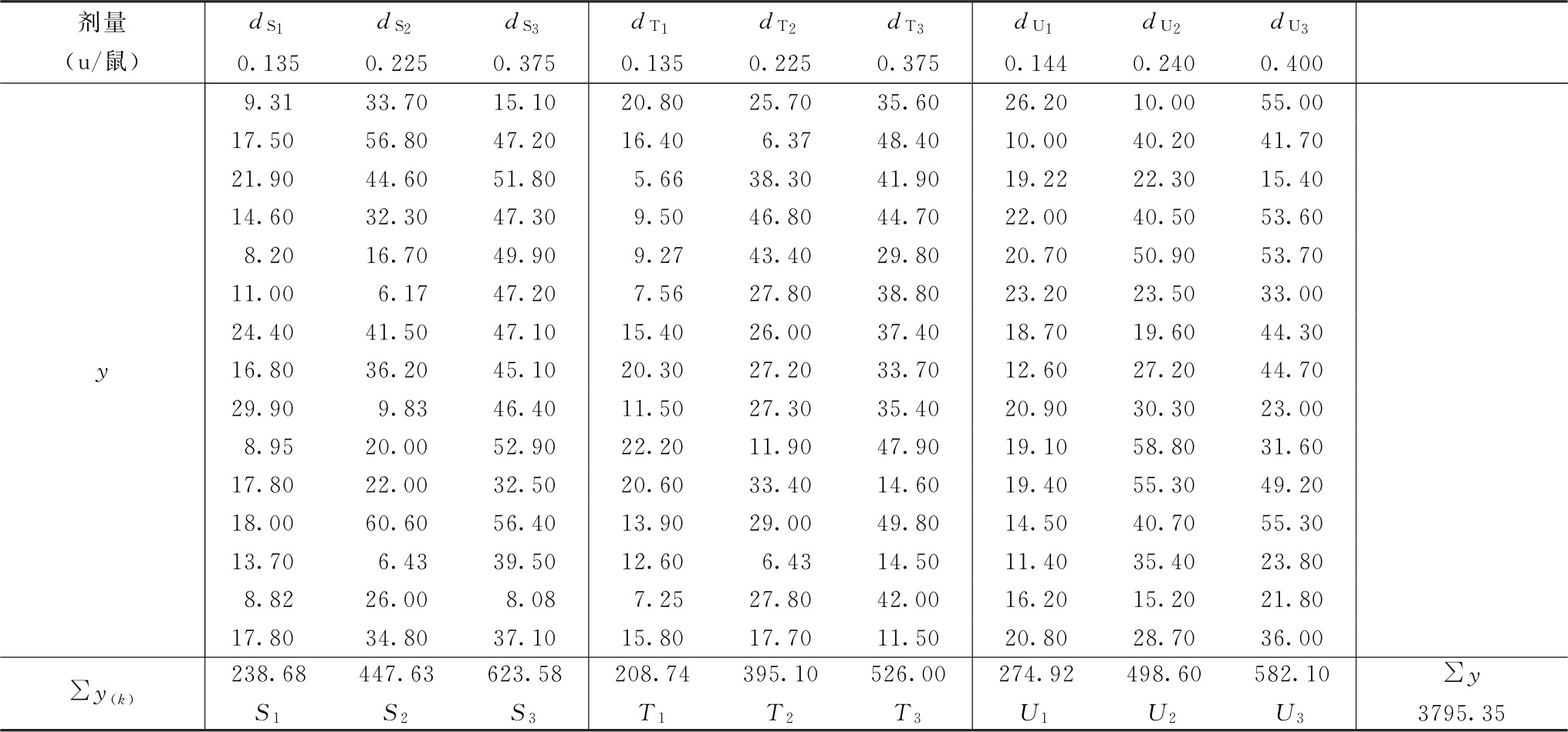
(3.3.3)法,K=9;每组15只小鼠,m=15
(1)按(14)式、(15)式、(20)式计算各项的差方和
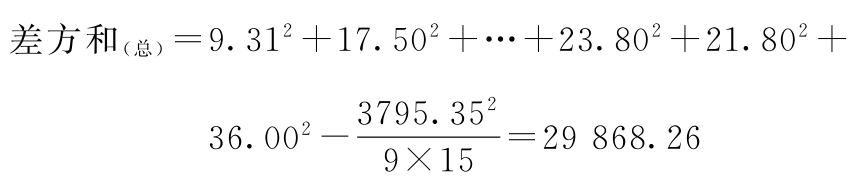
f(总)=9×15-1=134
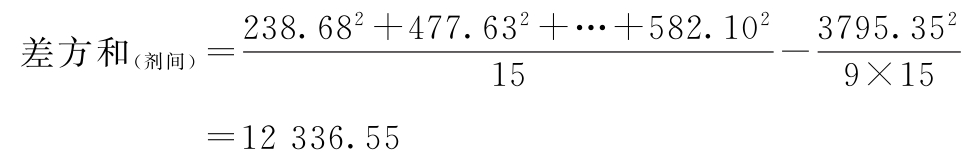
f(剂间)=9-1=8
差方和(误差)=29 868.26-12 336.55=17 531.71
f(误差)=134-8=126
(2)剂间变异分析及可靠性测验按(24)式及表六(3.3.3)法分析。

f(试品间)=2
各项分析结果见表2-2、表2-3。
表2-2 HCG(3.3.3)法剂间变异分析
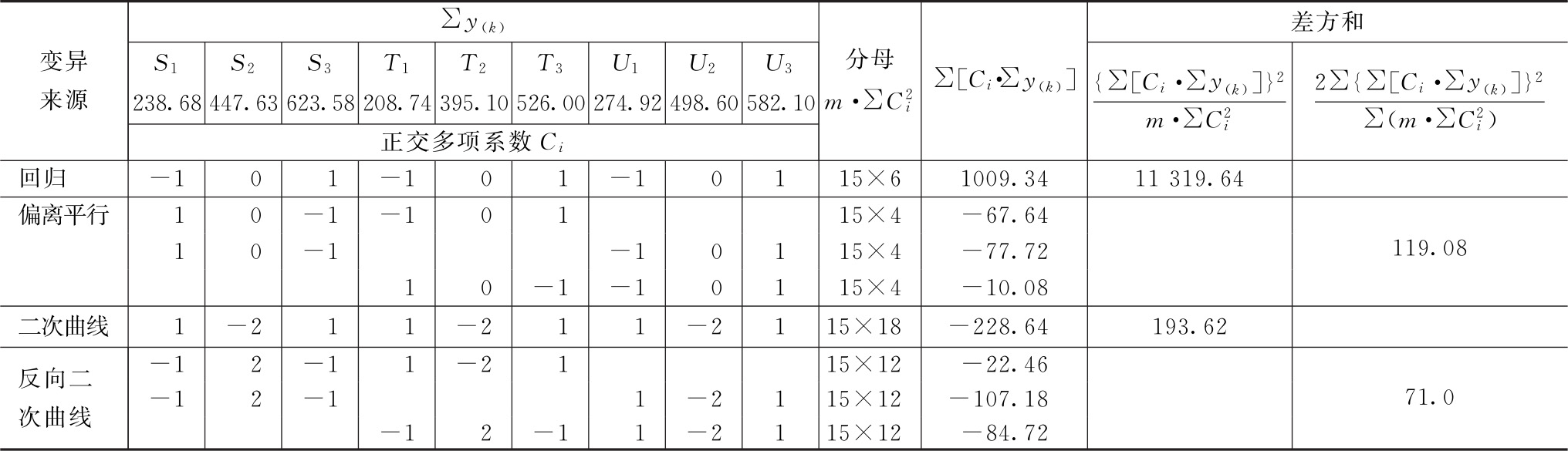
结论:回归非常显著,偏离平行、二次曲线、反向二次曲线均不显著,实验结果成立。
表2-3 HCG效价测定(3.3.3)法可靠性测验结果
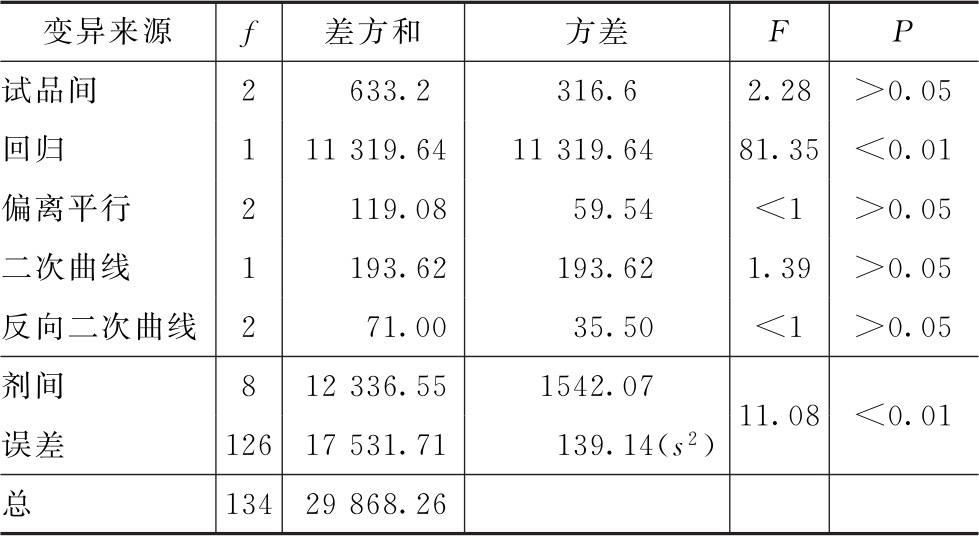
(3)效价(PT、PU)及可信限(FL)计算 按表十二(3.3.3)法及(30)~(33)式、(3)式、(8)式计算。
r=1∶0.6
I=0.222
s2=139.14
f=126
t=1.98
PT及其FL计算:

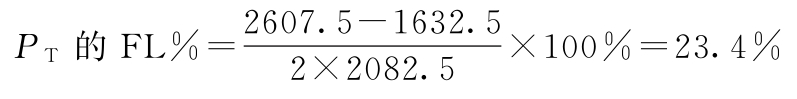
PU及其FL计算:
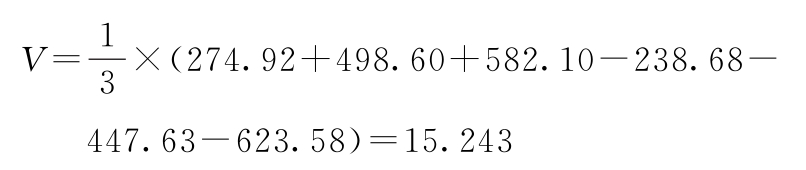
W=168.223 g=0.048
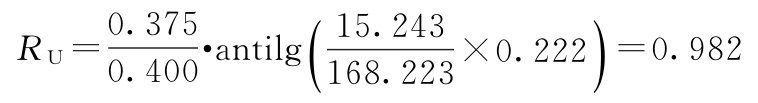
PU=500×0.982=491.0(u/安瓿)
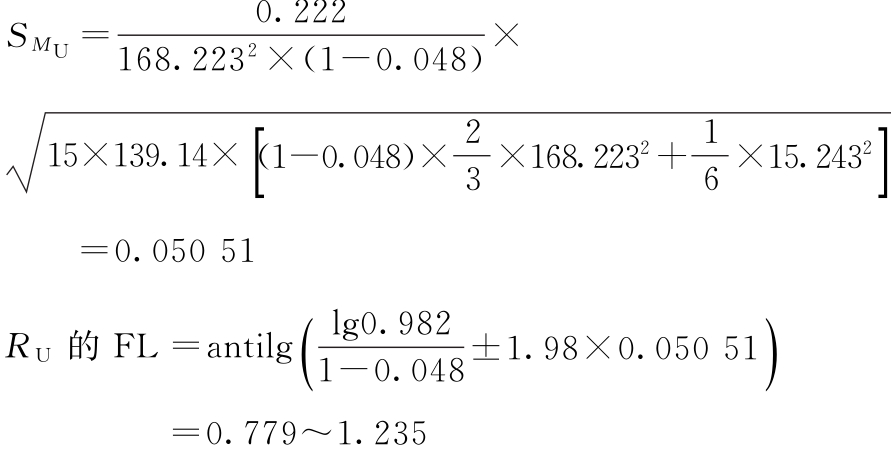
PU的FL=500×(0.779~1.235)=389.5~617.5(u/安瓿)
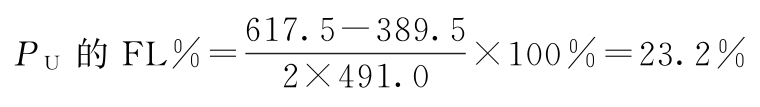
按(21)式计算s2
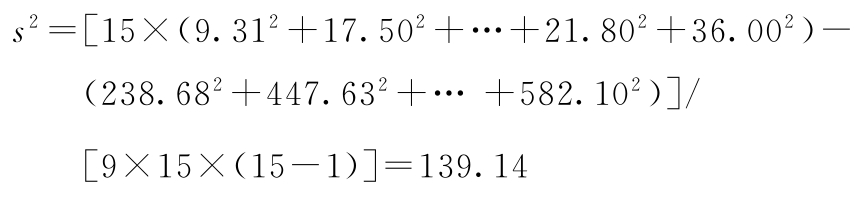
与表2-3结果相同。
例3 量反应平行线测定随机区组设计(3.3)法
新霉素效价测定——杯碟法
S为新霉素标准品
稀释液 :8.0u/ml
:8.0u/ml  :10.0u/ml
:10.0u/ml 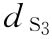 :12.5u/ml
:12.5u/ml
T为新霉素 标示量AT:670u/mg
稀释液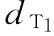 :8.0u/ml
:8.0u/ml 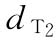 :10.0u/ml
:10.0u/ml 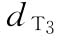 :12.5u/ml
:12.5u/ml
r=1∶0.8 I=0.0969
反应(y):抑菌圈直径(mm)
测定结果见表3-1。
表3-1 新霉素效价测定结果
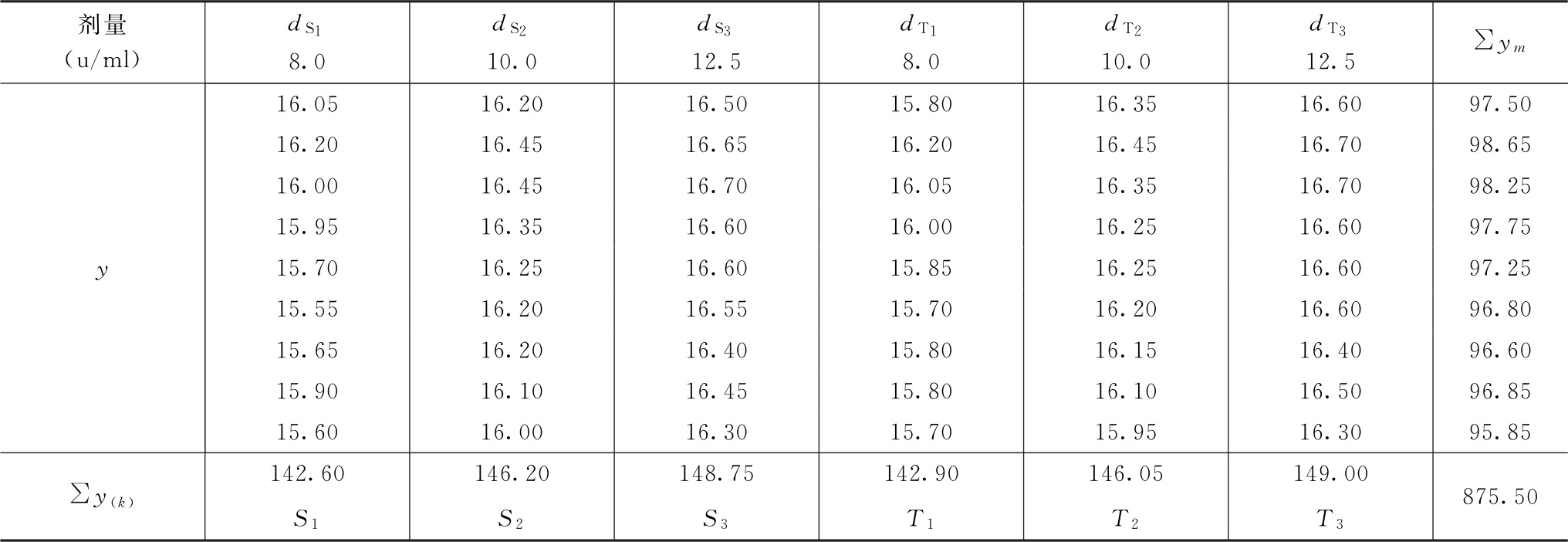
随机区组设计(3.3)法,K=6
不同双碟(碟间)是剂量组内所加的因级限制,共9个双碟,m=9。
(1)按(14)~(18)式计算各项差方和
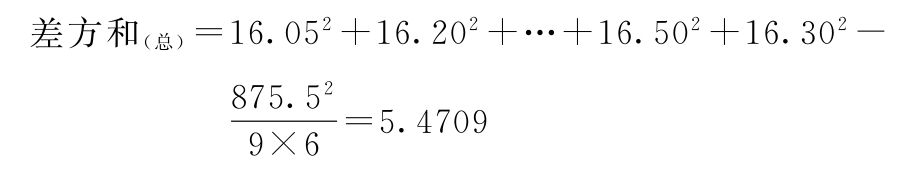
f=9×6-1=53
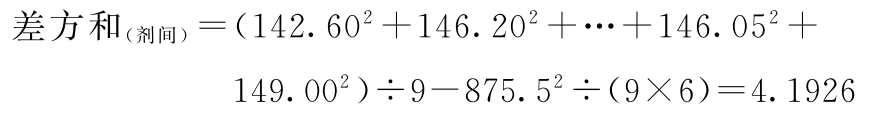
f=6-1=5
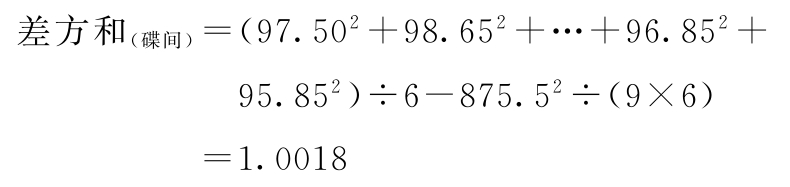
f=9-1=8
差方和(误差)=5.4709-4.1926-1.0018=0.2765
f=53-5-8=40
(2)剂间变异分析及可靠性测验 按表五(3.3)法计算,结果见表3-2、表3-3。
表3-2 新霉素(3.3)法剂间变异分析
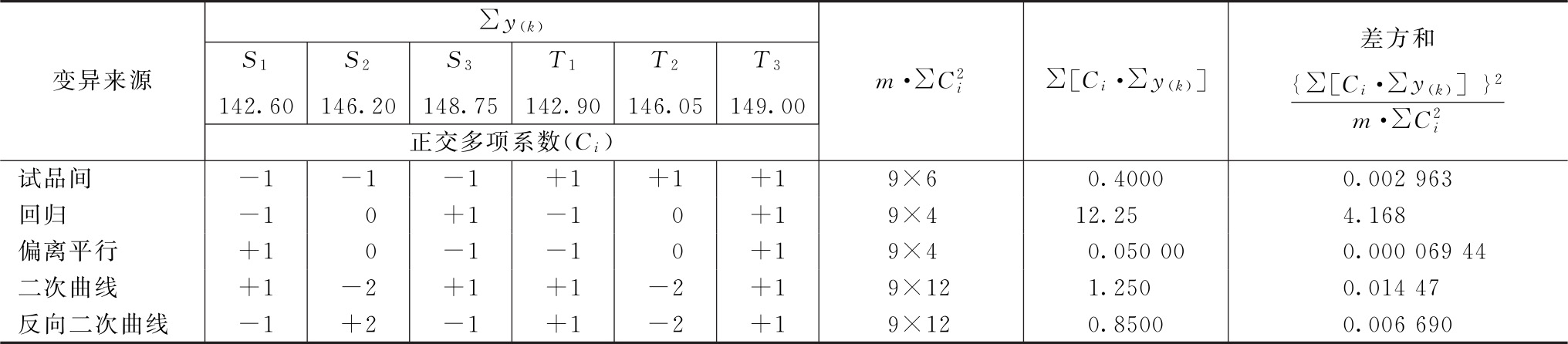
表3-3 新霉素效价测定(3.3)法可靠性测验结果
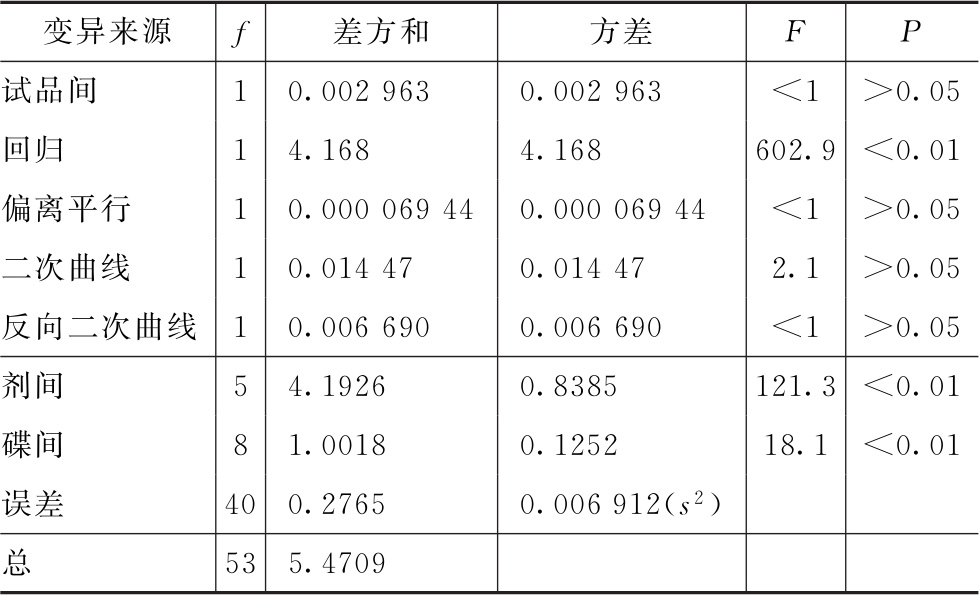
结论:回归非常显著(P<0.01),偏离平行、二次曲线、反向二次曲线均不显著(P>0.05),实验结果成立。组内(碟间)差异非常显著(P<0.01),分离碟间差异,可以减小实验误差。
(3)效价(PT)及可信限(FL)计算 按表十二(3.3)法及(30)~(33)式、(3)式、(8)式计算。
r=1∶0.8 I=0.0969 s2=0.006 912 f=40
t=2.02(P=0.95)
PT及其FL计算:
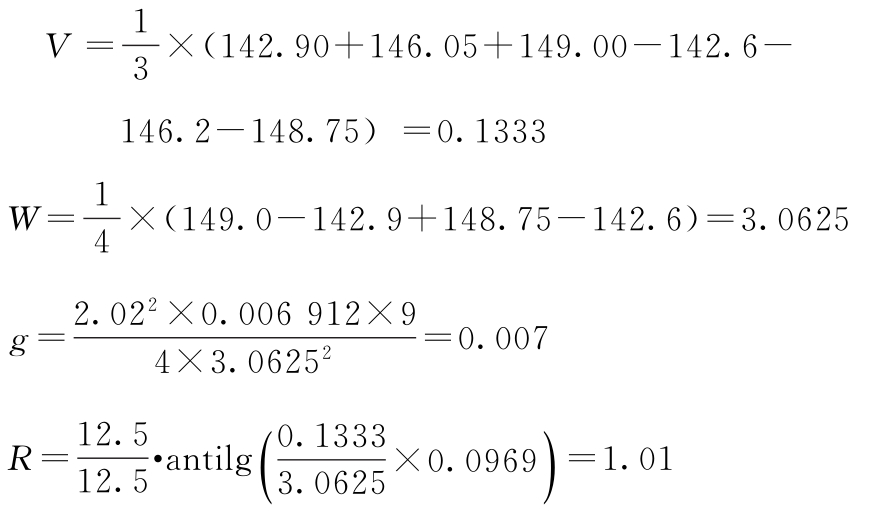
PT=670×1.01=676.70(u/mg)
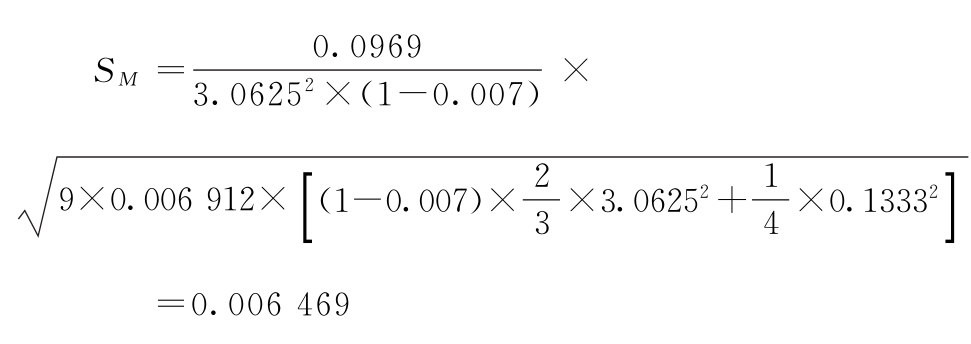
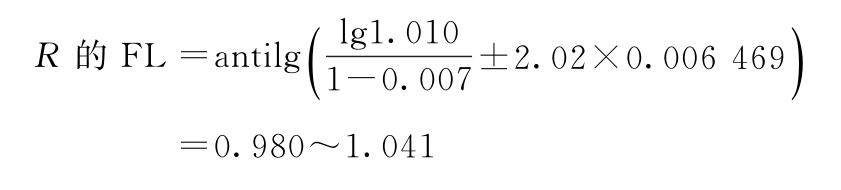
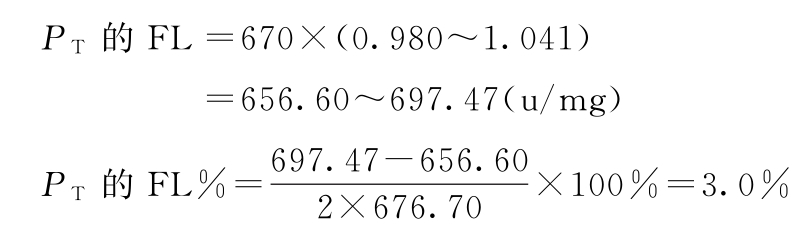
按(19)式计算s2
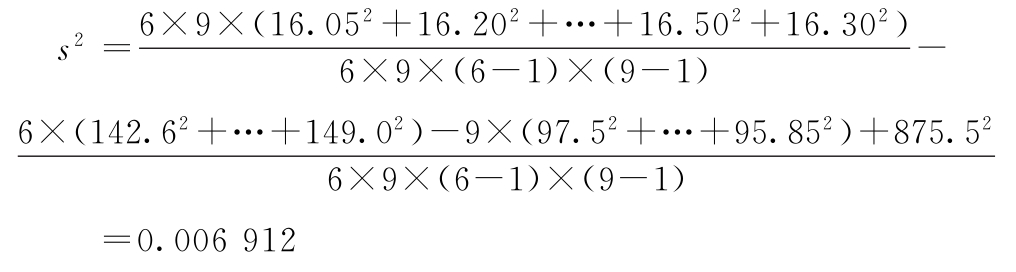
f=(6-1)×(9-1)=40
与表3-3结果相同。
例4 量反应平行线测定随机区组设计(2.2)法
缩宫素效价测定——大鼠离体子宫法
S为缩宫素标准品
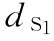 :0.0068u
:0.0068u 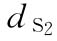 :0.009u
:0.009u
T为缩宫素注射液 标示量AT:10u/ml
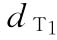 :0.008u
:0.008u 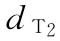 :0.0106u
:0.0106u
r=1∶0.75 I=0.125
反应(y):子宫收缩高度(mm)
测定结果见表4-1。
表4-1 缩宫素效价测定结果
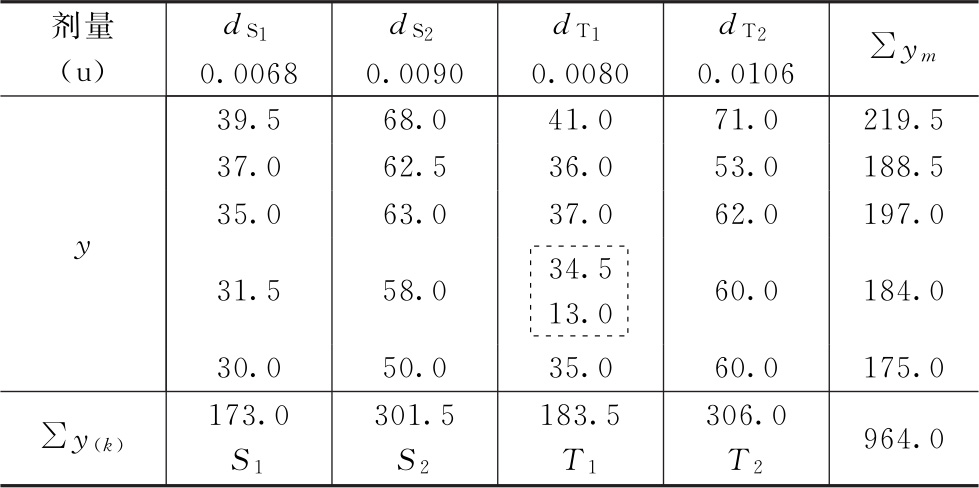
随机区组设计(2.2)法,K=4。每组4个剂量为一区组,其给药次序为剂量组内所加因级限制。各剂量组均为5个反应,m=5。
(1)特异反应处理 表4-1第三列第四行dT1的第4个数值特小,本例为随机区组设计按(10)式计算决定此值是否属特异值。
m=5 y1=13 y2=35 ym=41
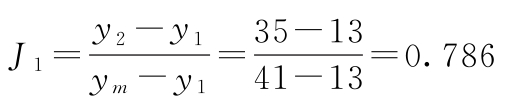
查表四,m=5时,J1=0.780,小于计算值0.786,故此值可以剔除。剔除后形成的缺项按(13)式补足。
C=41.0+36.0+37.0+35.0=149.0
R=31.5+58.0+60.0=149.5
G=173.0+301.5+149.0+306.0=929.5
K=4 m=5
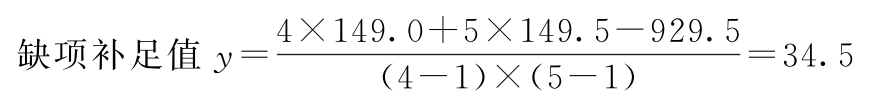
(2)按(14)~(18)式计算各项差方和 补足了一个缺项,误差项的自由度按(17)式再减1。
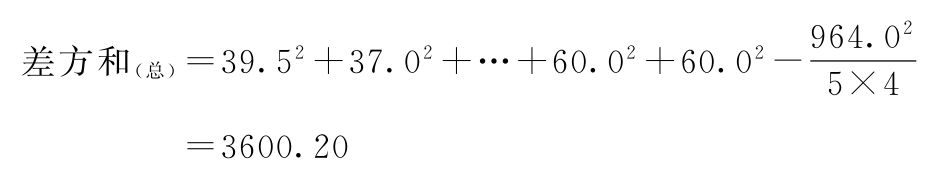
f=5×4-1=19
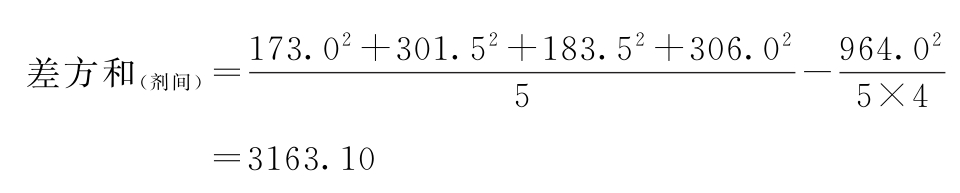
f=4-1=3
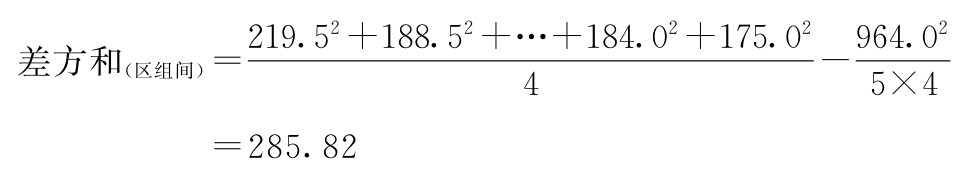
f=5-1=4
差方和(误差)=3600.20-3163.10-285.82=151.28
f=19-3-4-1=11
(3)剂间变异分析及可靠性测验 按表五(2.2)法计算,结果见表4-2、表4-3。
表4-2 缩宫素(2.2)法剂间变异分析
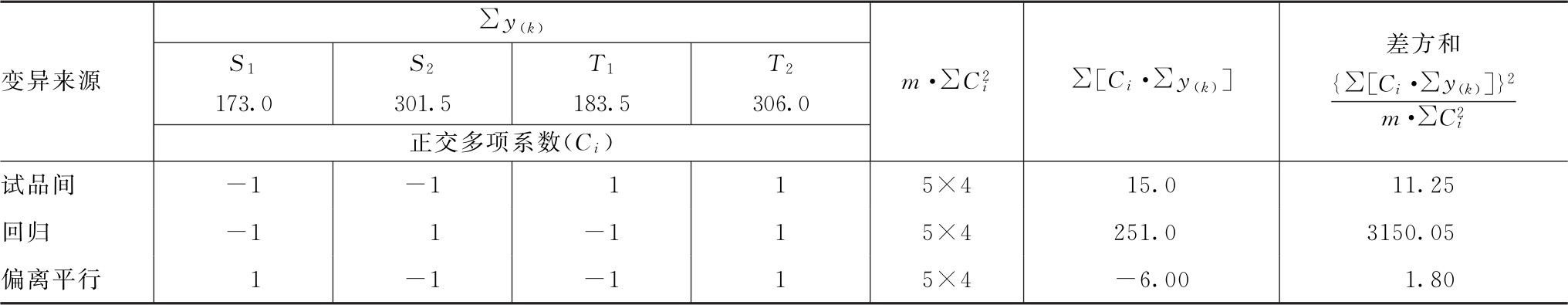
表4-3 缩宫素效价测定(2.2)法可靠性测验结果
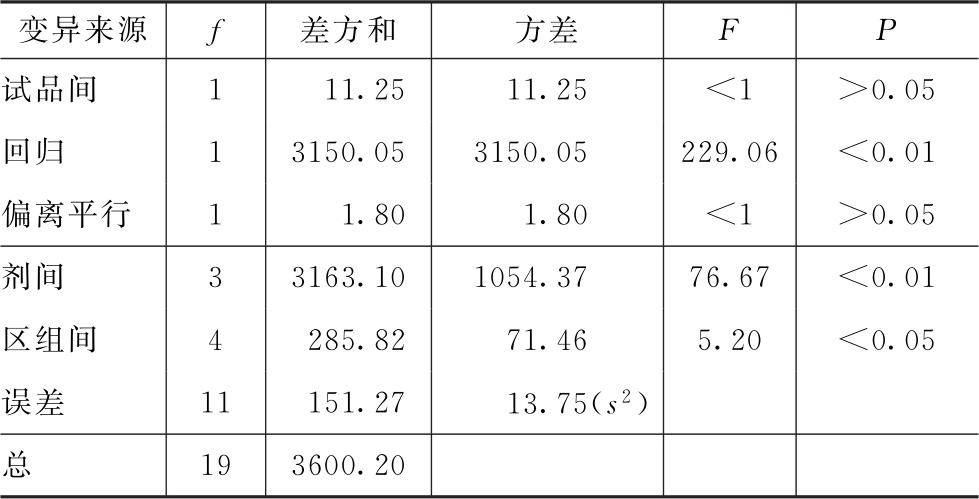
结论:回归非常显著(P<0.01),偏离平行不显著(P>0.05),实验结果成立。
区组间差异显著(P<0.05),分离区组间变异,可以减小实验误差。
缩宫素离体子宫效价测定,如区组间变异不显著,也可以不分离区组间变异,用随机设计方差分析法计算。
(4)效价(PT)及可信限(FL)计算 按表十二(2.2)法及(30)~(33)式、(3)式、(8)式计算。
r=1∶0.75 I=0.125 s2=13.75
f=11 t=2.20
PT及其FL计算:
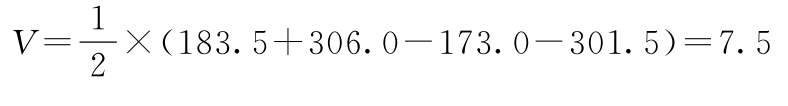
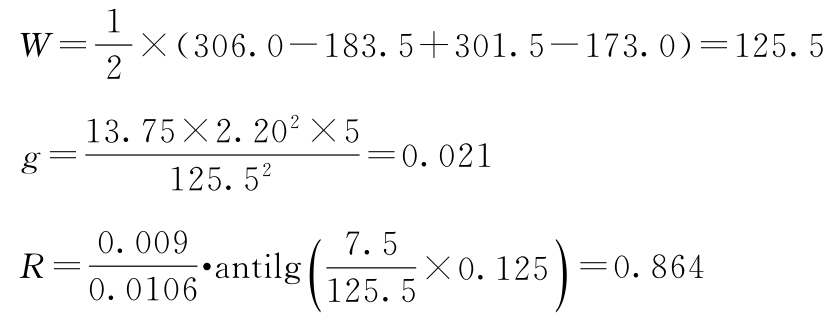
PT=10×0.864=8.64(u/ml)
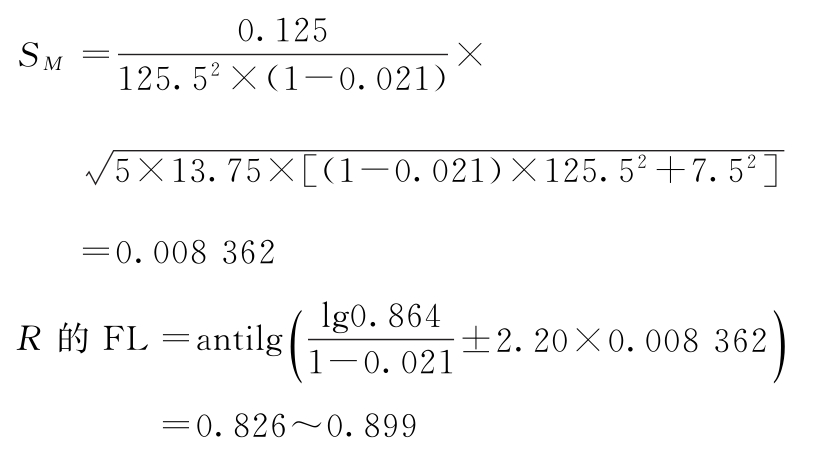
PT的FL=10×(0.826~0.899)=8.26~8.99(u/ml)
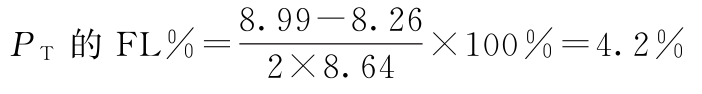
例5 量反应平行线测定(2.2)法双交叉设计
胰岛素效价测定——小鼠血糖法
S为胰岛素标准品
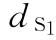 :25mu/ml, 0.25ml/鼠
:25mu/ml, 0.25ml/鼠
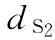 :50mu/ml, 0.25ml/鼠
:50mu/ml, 0.25ml/鼠
T为胰岛素 标示量AT:27u/mg
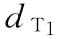 :25mu/ml, 0.25ml/鼠
:25mu/ml, 0.25ml/鼠
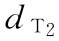 :50mu/ml, 0.25ml/鼠
:50mu/ml, 0.25ml/鼠
r=1∶0.5 I=0.301
反应值y:血糖值(mg%)
每组用鼠10只,m=10
测定结果按表九排列,见表5-1。
(1)方差分析 按(26)式、(27)式计算:
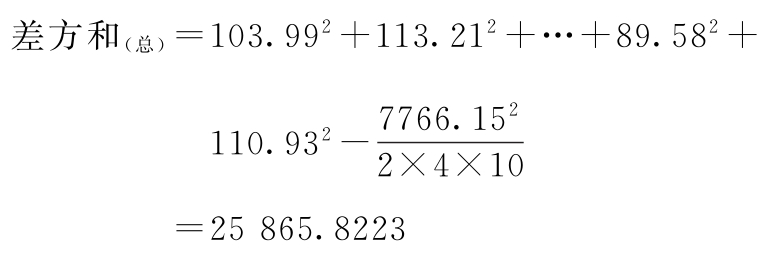
f(总)=2×4×10-1=79
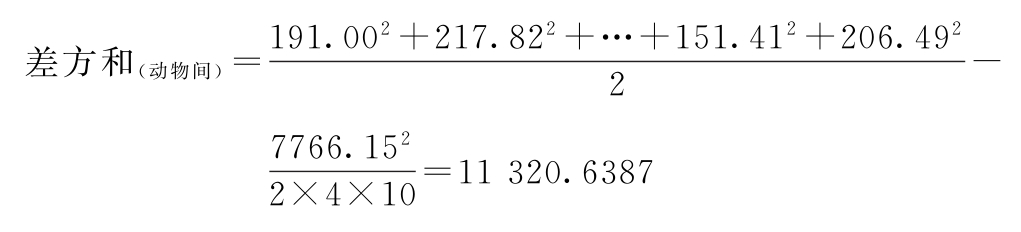
f(动物间)=4×10-1=39
(2)将表5-1中S、T各剂量组每一次反应值之和按表十及(22)式、(28)式、(29)式、(18)式计算各项变异的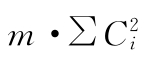 、∑(Ci·∑y)及差方和、方差,并进行可靠性测验,结果见表5-2、表5-3。
、∑(Ci·∑y)及差方和、方差,并进行可靠性测验,结果见表5-2、表5-3。
表5-1 胰岛素效价测定结果
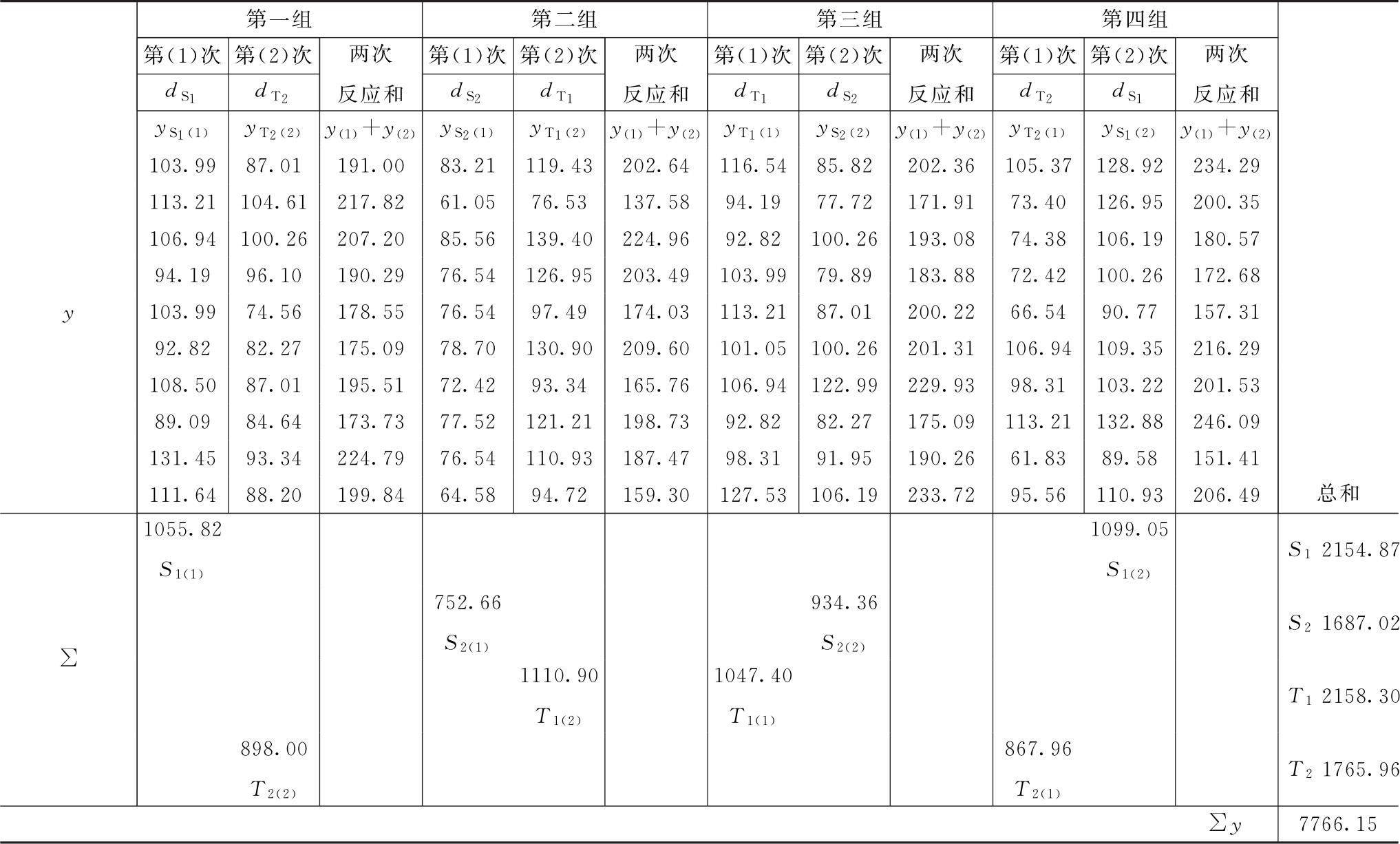
按(28)式、(29)式计算:

f(误差Ⅰ)=4×(10-1)=36

f(误差Ⅱ)=4×(10-1)=36
结论:回归非常显著,偏离平行不显著,实验结果成立。两次实验间的差异非常显著,用双交叉设计可以消除实验间变异对实验误差的影响,提高实验的精确度。
(3)效价(PT)及可信限(FL)计算:
用表5-1的S1、S2、T1、T2,按表十二(2.2)法及(30)式、(32)~(34)式计算。
r=1∶0.5 I=0.301
s2=99.2778 f=36 t=2.03
PT及其FL计算:

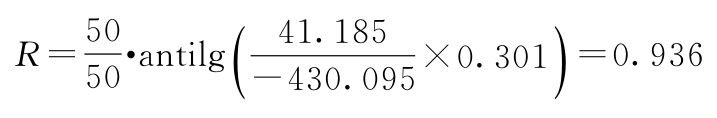
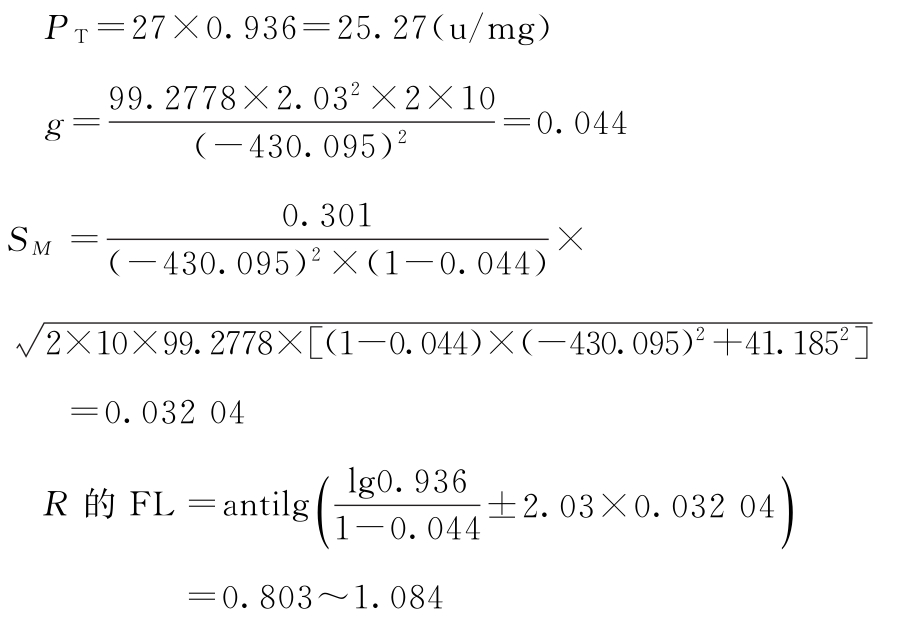
PT的FL=27×(0.803~1.084)=21.68~29.27(u/mg)
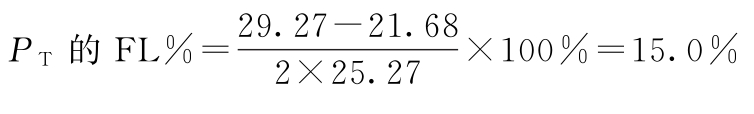
表5-2 胰岛素双交叉法剂间变异分析
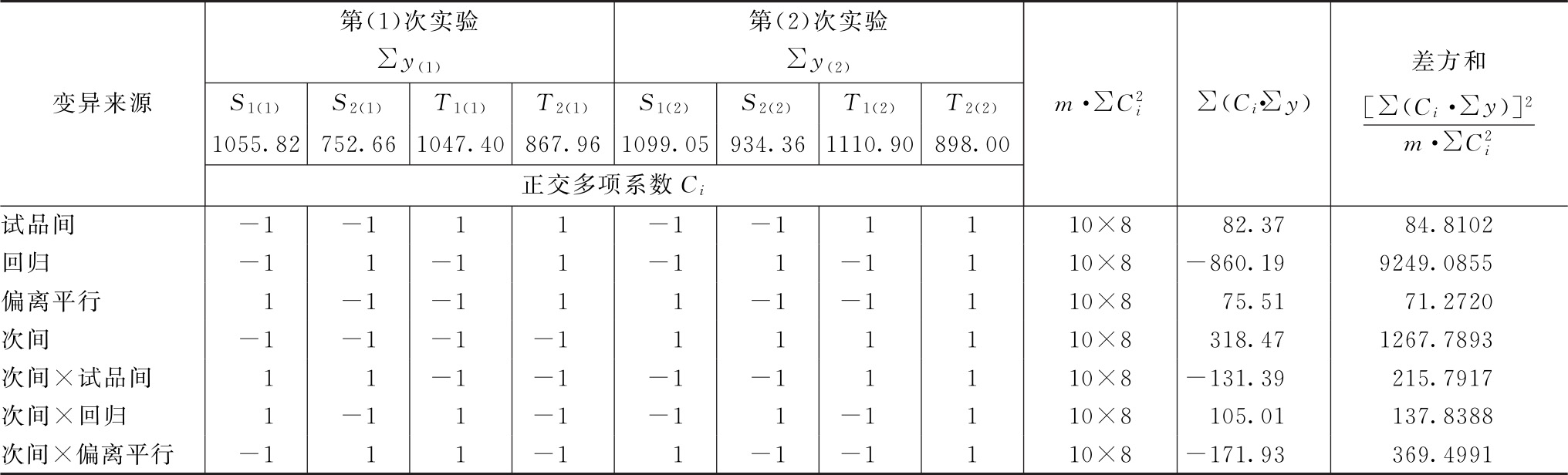
表5-3 胰岛素双交叉法可靠性测验结果
四、四参数回归计算法
四参数回归计算法系采用非线性模型进行量反应检定的一种统计分析方法。该法要求在一定剂量范围内,标准品(S)和供试品(T)的对数剂量x与反应值或反应值的特定函数y呈“S”或反“S”形关系,可拟合成四参数逻辑斯蒂(logistic)回归方程,拟合曲线对称于拐点,上下各有一渐进线。当S和T的活性组分基本相同时,两拟合曲线平行。S形量反应四参数逻辑斯蒂(logistic)曲线模型图见图2。
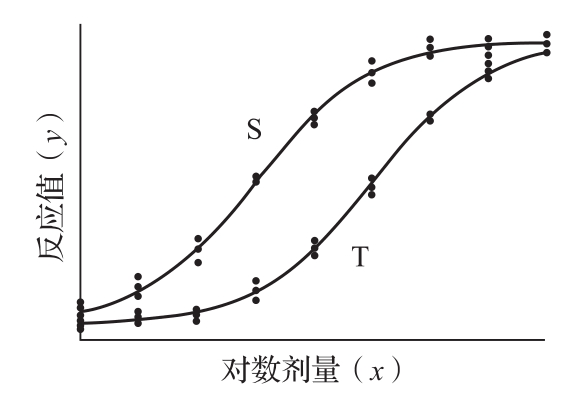
图2 S型量反应曲线的四参数逻辑斯蒂(logistic)模型
四参数逻辑斯蒂(logistic)曲线方程见(35)式:
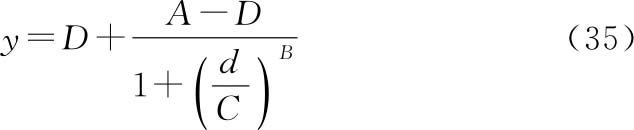
(36)式为另一种等价的方程形式:
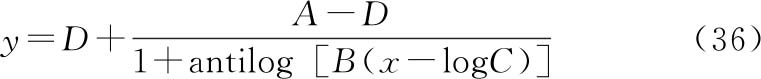
上述式中 y为反应值或反应值的特定函数;
d为标准品或供试品的各剂量;
x为对数剂量,x=logd;
A为d→0时的y(S形:下渐进线;反S形:上渐进线);
D为d→∞时的y(S形:上渐进线;反S形:下渐进线);
C为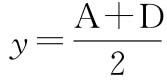 时对应的d,即50%效应浓度(EC50或ED50);
时对应的d,即50%效应浓度(EC50或ED50);
B为斜率因子(与EC50或ED50处曲线斜率相关)。
公式中对数的底数可取任一适用的底数,常以无理数e或10为底。A、B、C、D即为拟合曲线的4个特征性参数。本法主要以基于细胞的生物学活性测定法为例阐述四参数回归计算法的实验设计及运算过程。
1.实验设计
实验设计中要求S和T的剂量组数(n)应相等,每个剂量组反应值的个数(m)也应相等,且每个重复数应为独立重复。每组剂量间隔一般呈连续的等比稀释,也可采用非连续的独立稀释。实验过程中,应避免使用有严重位置效应的细胞孔,如会产生边缘效应的外周孔,S和T加样位置应尽量遵循随机、均衡排列的原则,也可选用随机区组设计,以减少实验误差。
2.异常值处理
获取并记录试验数据后,需采用一定的策略鉴别和处理异常值,应调查产生异常值的原因。对于技术性或物理性等明确原因导致的异常值可直接剔除,如细胞孔污染、加样错误等;而对没有查明原因的异常值原则上不应剔除,即使剔除也应采用合适的统计学方法。关于异常值剔除的统计学方法及其缺项补足,见本通则“三、量反应平行线测定法”中异常值剔除项。
3.四参数逻辑斯蒂(logistic)模型拟合
一般采用适宜的计算机软件中四参数逻辑斯蒂(logistic)自由模型和约束模型,按照非线性最小二乘法的原则,进行S和T剂量反应曲线的自由拟合和约束拟合,分别获得S和T自由拟合及约束拟合曲线中A、B、C、D四个参数的估计值。约束模型为一平行曲线模型,其中S与T拟合方程的A、B、D三个参数的估计值分别相同,仅参数C的估计值不同。
4.方差分析
按(37)~(39)式将约束模型总变异进行分解,采用适宜的计算机软件计算各项变异的差方和、自由度(f),按(18)式计算各变异项方差。
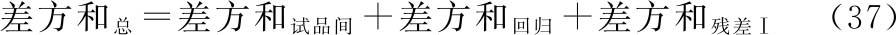
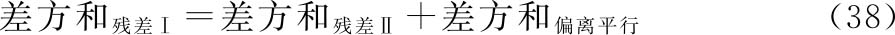
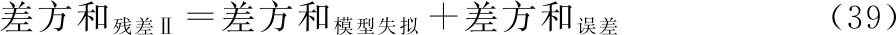
上述式中 差方和残差Ⅰ为标准品和供试品约束模型的残差平方和;
差方和残差Ⅱ为标准品和供试品自由模型的残差平方和。
5.可靠性测验
通过对剂间变异的分析,以测验S和T的对数剂量和反应的关系是否显著偏离平行曲线。剂间变异分析为试品间、回归、偏离平行和模型失拟四项:残差Ⅱ的方差用以进行试品间、回归和偏离平行三项变异的F测验,误差项的方差用以进行模型失拟的F测验。由适宜的计算机软件计算获得各变异项的P值。当P<0.0 5或P<0.0 1,即认为在此检验水准下该项变异有显著意义。
可靠性测验结果判断 可靠性测验结果,回归项应非常显著(P<0.01);偏离平行和模型失拟均应不显著(P≥0.05)。个别情况下,当残差Ⅱ或误差项的方差非常小时,偏离平行或模型失拟检验结果可能判为显著,建议此时以残差Ⅱ或误差质控图中日常平均水平替代该次试验水平进行计算。
试品间一项不作为可靠性测验的判断标准。试品间变异非常显著者,重复试验时,应参考所得结果重新估计T的效价或重新调整剂量再进行试验。
满足上述条件,即可认为实验结果的可靠性成立。
6.效价(PT)及置信区间(CL)计算
对于可靠性成立的实验结果,方可按等反应剂量比的原则,采用约束模型中S和T拟合曲线EC50的比值,计算供试品的相对效价(R)。
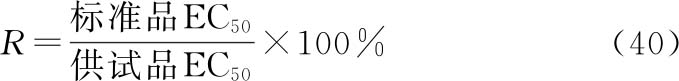
再按下式计算供试品的效价(PT)
PT=AT·R
采用经验证的适宜计算机软件计算R的置信区间,将R置信区间的高限和低限分别乘以AT得PT置信区间的高限和低限。对于多次实验结果的合并计算见本通则“六、实验结果的合并计算”部分。
在进行本法运算时,选择的计算机软件应能获得与本法实例一致的计算结果。
对符合S形量反应模型的供试品进行效价计算时,如果没有合适的计算机软件或统计专家的帮助,无法使用四参数回归计算法的情况下,也可选择剂量反应曲线中呈近似直线关系的一段剂量范围,将反应值进行适宜转换,按“三、量反应平行线测定法”估计效价。
7.实例
例6 四参数回归计算法
人粒细胞刺激因子(GCSF)生物学活性测定——NFS-60细胞/MTT比色法
测定方法见人粒细胞刺激因子生物学活性测定法(通则3525),试验中将S和T(标示量AT:2.4×107IU/300μg)用基础培养液稀释至每1ml含400IU,然后做2倍系列稀释,共8个稀释度,每个稀释度做2孔,酶标仪吸光度测定结果见表6-1。以yi,j,k表示S或T每一剂量水平的反应值,其中i表示S或T处理组,i=0时为S处理组,i=1时为T处理组;j表示第j个剂量组;k表示每一剂量水平的第k个重复数。
(1)四参数逻辑斯蒂(logistic)模型拟合
采用适宜的计算机软件中四参数逻辑斯蒂(logistic)自由模型对表6-1中的数据进行S和T剂量反应曲线的拟合,其决定系数R2分别为0.997和0.999,S和T自由模型拟合曲线中A、B、C、D四个参数的估计值见表6-2。
表6-1 GCSF生物学活性(NFS-60细胞/MTT比色法)测定结果
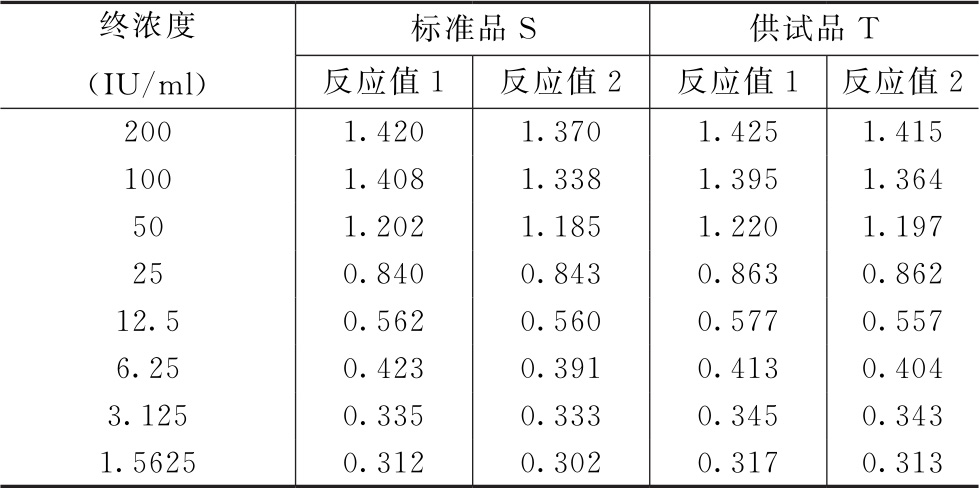
表6-2 S和T自由模型拟合曲线中各参数的估计值
以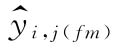 表示自由模型每一剂量水平的拟合值,则:
表示自由模型每一剂量水平的拟合值,则:
S自由模型拟合方程: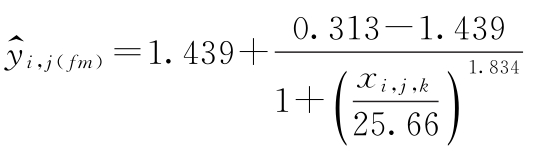
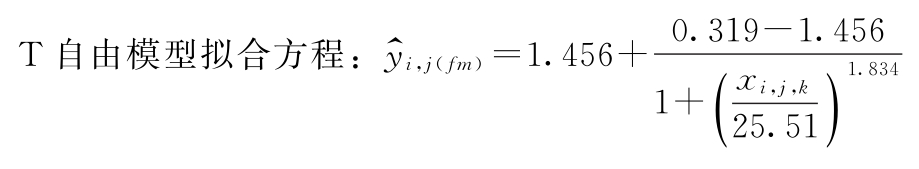
再采用适宜的计算机软件中四参数logistic约束模型对表6-1中的数据进行S和T剂量反应曲线的拟合,S和T约束模型拟合曲线中A、B、C、D四个参数的估计值见表6-3。
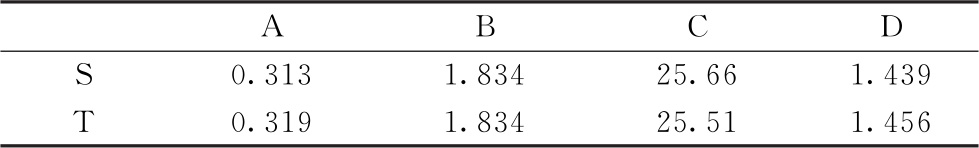
表6-3 S和T约束模型拟合曲线中各参数的估计值
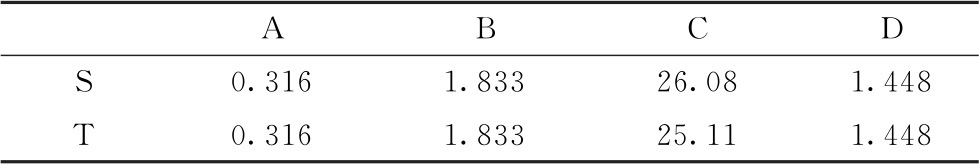
以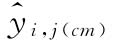 表示约束模型每一剂量水平的拟合值,则:
表示约束模型每一剂量水平的拟合值,则:

(2)方差分析
试验数据列表 根据表6-1计算S和T处理组所有反应值的平均值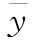 、S或T处理组所有反应值的平均值
、S或T处理组所有反应值的平均值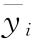 、S或T第j个剂量组内反应值的平均值
、S或T第j个剂量组内反应值的平均值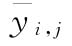 和每一剂量组反应值的相对标准偏差RSD;按上述拟合方程分别计算自由模型中S和T每个剂量水平的拟合值
和每一剂量组反应值的相对标准偏差RSD;按上述拟合方程分别计算自由模型中S和T每个剂量水平的拟合值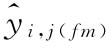 ;约束模型中S和T每个剂量水平的拟合值
;约束模型中S和T每个剂量水平的拟合值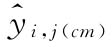 ;将结果列入表6-4。
;将结果列入表6-4。
表6-4 S和T试验数据列表
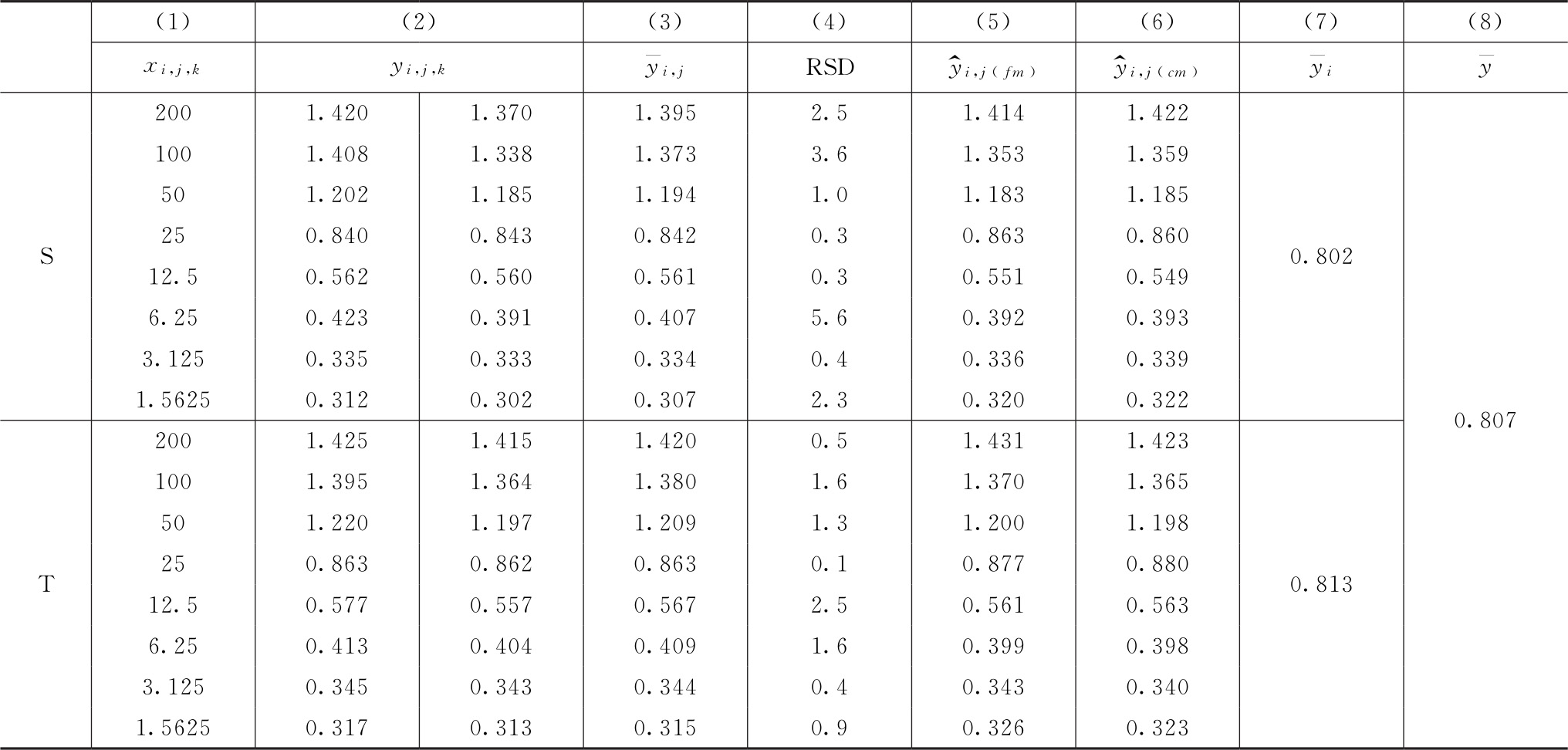
将总变异进行分解,计算各项变异的差方和与自由度(f)。
总变异
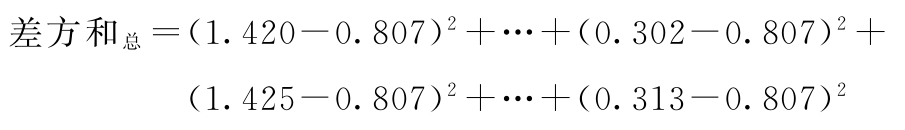
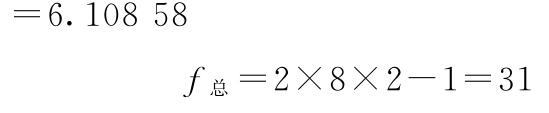
试品间变异
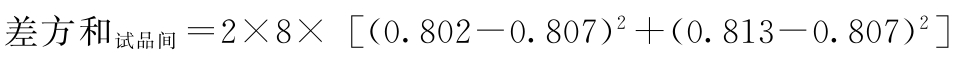
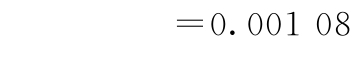
f试品间=2-1=1
回归项变异
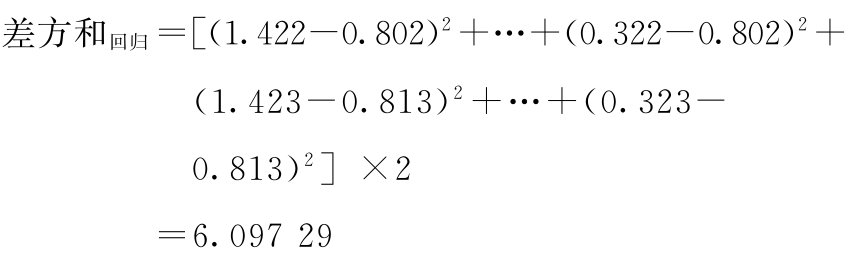
f回归=5-2=3
偏离平行项变异

f偏离平行=8-5=3
残差Ⅱ变异
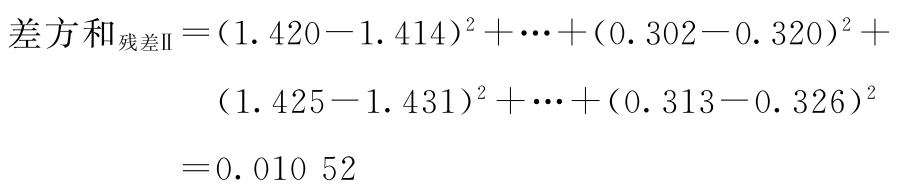
f残差Ⅱ=2×8×2-8=24
①失拟项变异
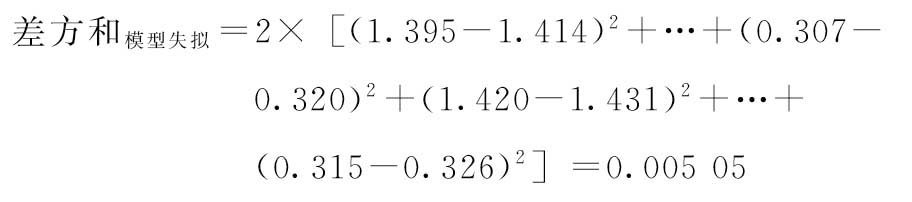
f模型失拟=2×8-8=8
标准品失拟项变异:
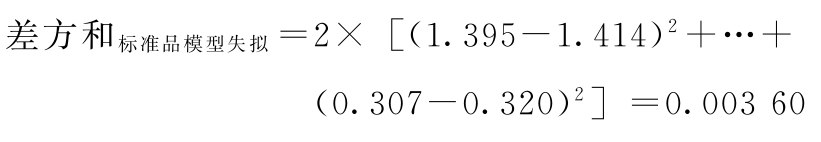
f标准品模型失拟=8-8/2=4
供试品失拟项变异:
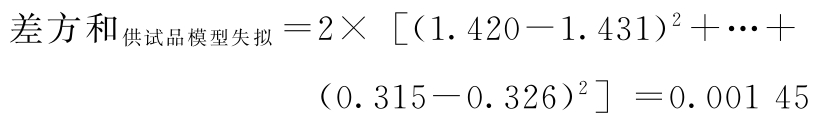
f供试品模型失拟=8-8/2=4
②误差项变异
差方和误差=0.010 517-5.056E-03=0.005 46
f误差=2×8×2-2×8=16
(3)可靠性测验
按本通则“三、量反应平行线测定法”中(18)式计算各变异项方差,将方差分析结果列表进行F测验,见表6-5。
表6-5 方差分析及F测验结果
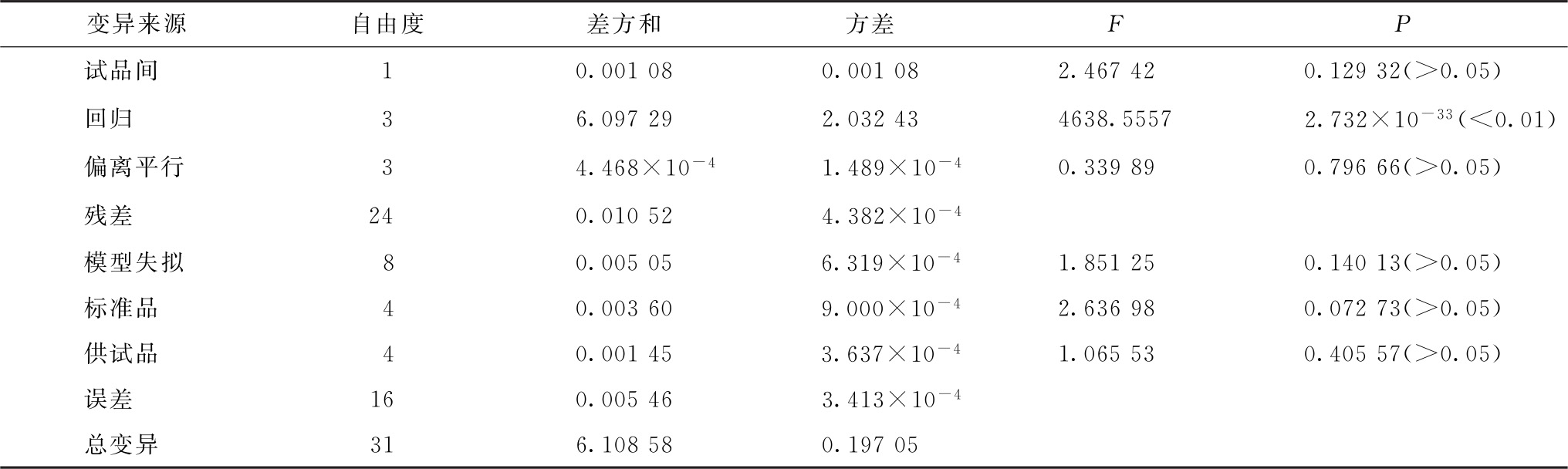
注:表中残差为残差Ⅱ。
可靠性测验结果判断 根据历史数据设定S和T拟合曲线R2应≥0.98,每一剂量组反应值的RSD应≤10%。可靠性测验结果判断如下:
①S和T拟合曲线的R2分别为0.997和0.999,均符合规定。
②S和T每一剂量组内反应值的RSD均<10%,均符合规定。
③回归项非常显著;偏离平行和失拟检验项均不显著。
结论:实验结果成立。
(4)效价(PT)及置信区间计算
相对效价(R)按约束模型中S和T拟合曲线EC50(见表6-3中C值)的比值计算。
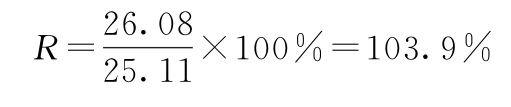
再按下式计算供试品效价:
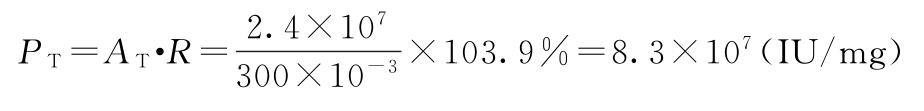
采用适宜的计算机软件,计算R的置信区间为98.3%~109.7%,PT的置信区间为(7.9~8.8)×107IU/mg,R和PT的相对置信区间均为94.6%~105.6%。
五、质反应的生物实验数据分析
某些无法定量测量的检验,每个试验单位只有二分的测量结果,例如观察到动物的存活或死亡,细胞的响应超过或未超过预设的限度等。处理该类检验适用于质反应测定法。
质反应测定法与量反应测定法的区别在于,在每个剂量下的n次独立重复测量仅得到一个单一的值,即响应比例。将对数剂量对响应比例作图,通常将得到S形的剂量响应曲线。该曲线通常可以通过累积正态分布函数表示。使用累积正态分布函数的模型通常称为概率单位(probit)模型,使用逻辑斯蒂分布函数的模型通常称为logit模型,两者计算结果不存在有意义的差异,均可接受。常用Bliss迭代法计算模型参数。
1.概率单位(probit)转换的平行线法
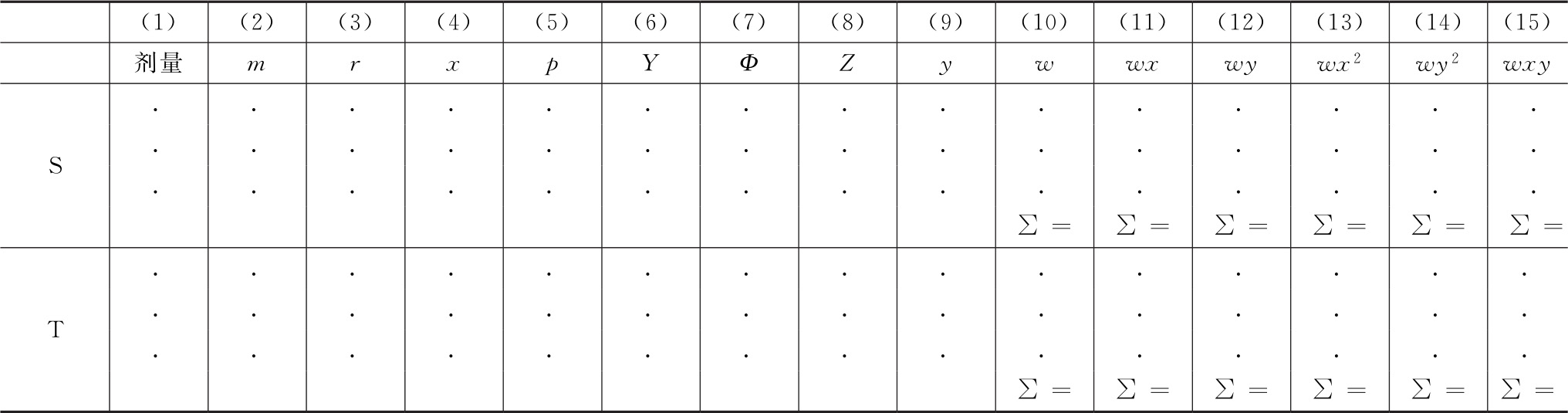
(1)将实验数据输入工作表Ⅰ(表十三),按工作表Ⅰ和工作表Ⅱ的循环迭代计算 首先将试验数据输入工作表Ⅰ以下数字标识的各列。
列(1)为标准品或供试品的剂量。
列(2)为该剂量下的单位数m。
列(3)为该剂量下产生阳性响应的单位数r。
列(4)为对数剂量x。
列(5)为每组阳性响应的比例p=r/m。
从列(6)开始,循环迭代计算结果:
列(6)第一个循环时,列Y全部填写0。
列(7)累积标准正态分布方程对应的值Φ=Φ(Y)。
工作表Ⅰ的列(8)到列(10)用以下公式计算。
列(8)

列(9)

列(10)

工作表Ⅰ的列(11)到列(15)的wx、wy、wx2、wy2和wxy可以由该表的列(4)、(9)和(10)算得,对每供试品和标准品分别计算列(10)~(15)各列之和(∑)。
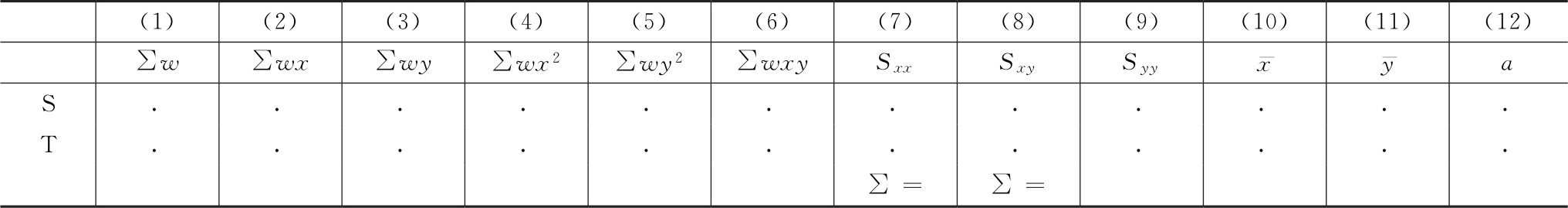
将工作表Ⅰ计算得到的求和转移至工作表Ⅱ(表十四)中的列(1)~(6),通过以下公式计算工作表Ⅱ列(7)~(11)。
列(7)
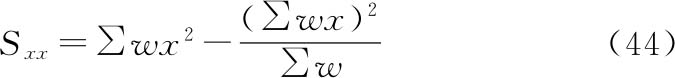
列(8)
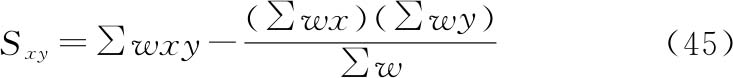
列(9)
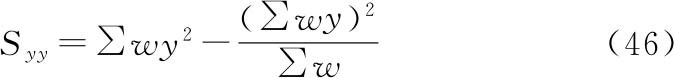
列(10)

列(11)

表十三 质反应模型的工作表Ⅰ模板
表十四 质反应模型的工作表Ⅱ模板
供试品和标准品的共同斜率参数b以(49)式计算:

供试品和标准品的截距参数a以(50)式计算,并填入工作表Ⅱ的列(12):

用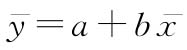 公式计算的结果替换工作表Ⅰ中的列(6),开始重复循环,直到两个循环计算出的Y值差异足够小后停止(例如,两个连续循环中算得的Y值差异小于10-8)。
公式计算的结果替换工作表Ⅰ中的列(6),开始重复循环,直到两个循环计算出的Y值差异足够小后停止(例如,两个连续循环中算得的Y值差异小于10-8)。
(2)可靠性测验 通过对变异的分析,以测验S和T的对数剂量和反应的关系是否显著偏离线性和平行性。S和T需至少涵盖3个剂量,偏离线性的程度可以通过以下方法测量。在工作表Ⅱ中增加列(13),由(51)式计算:

对工作表Ⅱ列(13)的计算结果求和得到χ2值,以自由度f=K-2h查χ2表(K=dh,d为每个测试品的浓度值;h为总的测试品数目,只有一个标准品和一个供试品,则h=2),可得到尾区概率P。当P<0.05或P<0.01,即为在此概率水平下对偏离线性有显著意义。
偏离平行性的程度可以通过以下方法测量。工作表Ⅱ中的数据通过(52)式计算得到χ2值,以自由度f=h-1查χ2表,可得到尾区概率P。当P<0.05或P<0.01,即为在此概率水平下对平行性的偏离有显著意义。
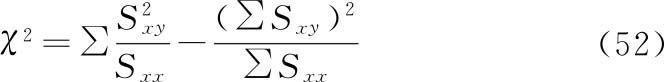
可靠性检验结果,偏离线性和平行性应不显著(P>0.05)。显著偏离线性应当复试。实验者在剂量设置时应当尽可能保证S和T的对数剂量均覆盖各自S形曲线半数反应量的两侧,即最低稀释度有半数以上的动物响应,最高稀释度有半数以下的动物响应。同时,S和T曲线的水平距离应当尽可能小,以充分保证拟合的稳健性和检验结果的可靠性。
显著偏离线性应当复试,但如果有理由保留该检验,公式需要微调。(56)式中的t应当修正为偏离线性检验中相同自由度f=K-2h对应的P=0.05处的t值,s2应当修正为偏离线性检验中的χ2值除以自由度f=K-2h。
同时,平行性检验也需要微调。偏离平行性检验的χ2值除以自由度f=h-1后,再除以上述计算得到的s2,得到一个F比率值,分子和分母分别对应自由度f=h-1和f=K-2h,在0.05的显著水平上进行F检验以判断平行性。
(3)效价(PT)及可信限(FL)计算 按工作表Ⅱ得到的aT、aS、b、Sxx、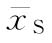 、
、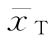 ,代入(53)~(58)式,计算M、R、PT和FL等。
,代入(53)~(58)式,计算M、R、PT和FL等。

式中 aT为供试品的截距参数,aS为标准品的截距参数。


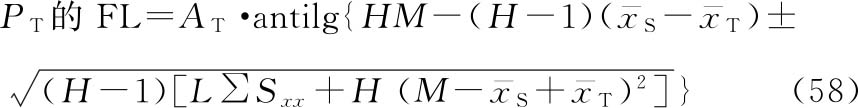
2.半数反应量计算
半数反应量包括半数有效量(ED50或IC50)和半数致死量(LD50)等,是衡量药物有效性和安全性的常用指标,在质反应测定法中,表现为百分之五十单位响应时的剂量。供试品的半数反应量常用probit或logit模型计算,通过Bliss迭代法具体实现。
Bliss迭代法按“五、质反应的生物实验数据分析”中的步骤开展,按其中的“1.(2)可靠性测验”进行线性检验,不需要进行平行性检验。
按表十四得到的a、b、Sxx、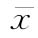 ,代入(59)~(63)式,计算M、ED50和FL等。
,代入(59)~(63)式,计算M、ED50和FL等。


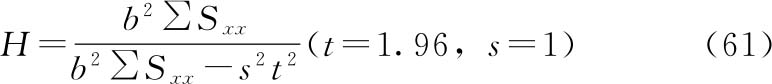

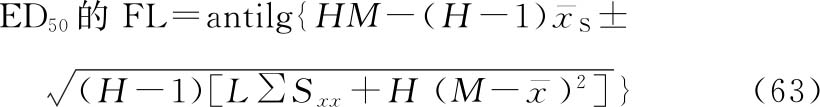
3.实例
例7 吸附白喉疫苗的效价测定——豚鼠毒素攻击法
白喉疫苗(估计效价为140u/瓶)与标准品(标示效价132u/瓶)对照检验。制备如表7-1所示的1ml针剂,注射经随机分组的豚鼠。一段时间后,向豚鼠注射白喉毒素,存活的豚鼠数在表7-1中记录。
表7-1 吸附白喉疫苗效价测定的试验设计和原始数据
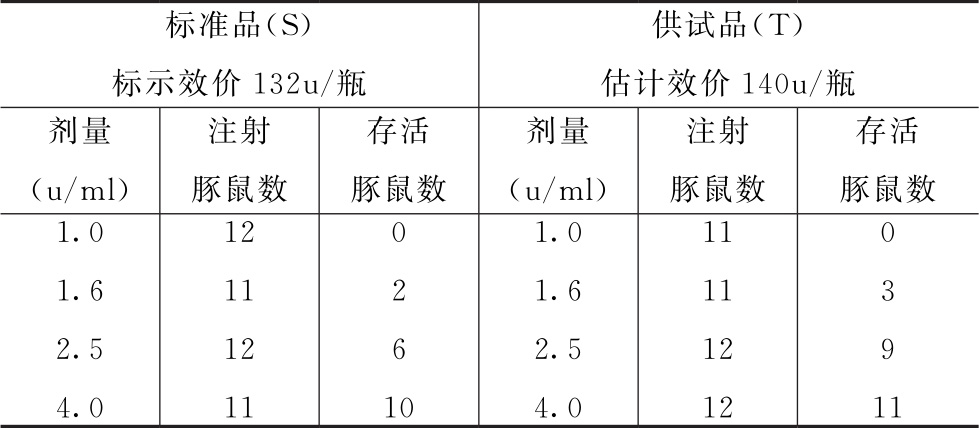
(1)输入实验数据,进行工作表Ⅰ和工作表Ⅱ的循环迭代 使用probit模型,通过Bliss迭代法计算出收敛后的工作表Ⅰ(表7-2)和工作表Ⅱ(表7-3)。
表7-2 收敛后的工作表Ⅰ
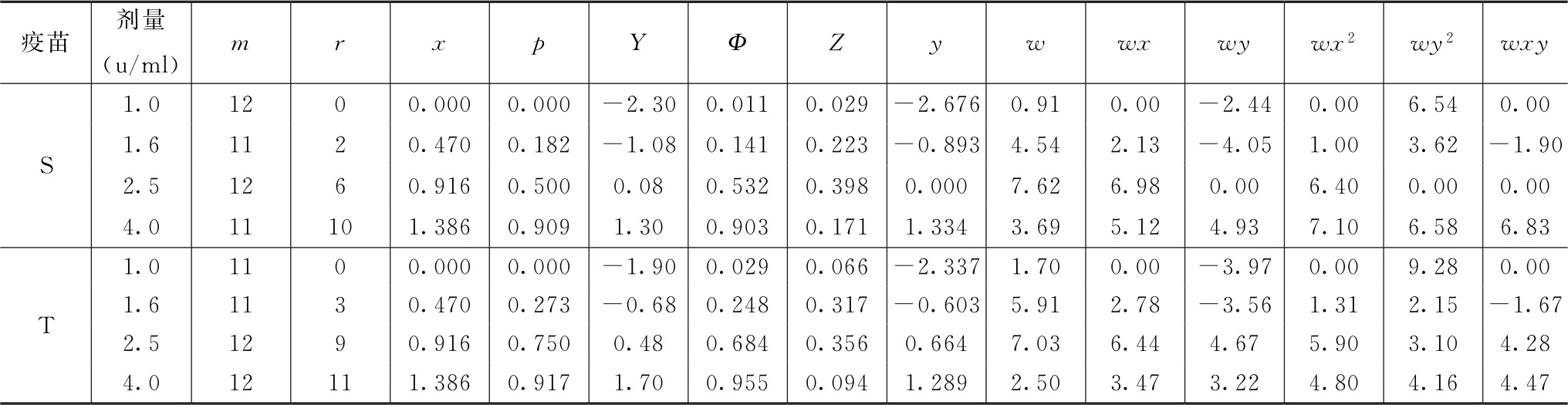
表7-3 收敛后的工作表Ⅱ

(2)可靠性测验 检验非线性:4个自由度的χ2值是0.340+1.022=1.361,对应P=0.851,统计学不显著。
检验非平行性:1个自由度的χ2值是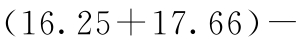
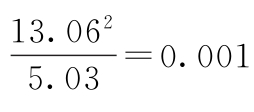 ,相应的P值是0.974(此处P值使用修约后的χ2=0.001计算),统计学不显著。
,相应的P值是0.974(此处P值使用修约后的χ2=0.001计算),统计学不显著。
结论:偏离线性和平行性不显著,试验结果成立。
(3)效价(PT)及可信限(FL)计算 效价(PT)及可信限(FL)的计算,按(53)~(58)式计算。

R或PT的相对置信区间为76.3%~132.5%。
例8 肉豆蔻提取物(PDK)对癌细胞的半数抑制率(IC50)计算
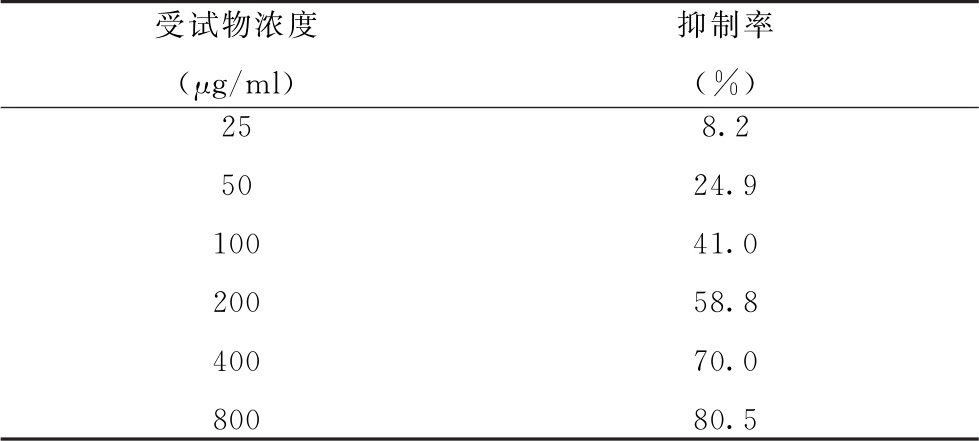
采用MTT法,取对数生长期的SGC-7901细胞以100μl/well接种于培养板内,培养12小时。分别加入含不同浓度PDK的培养液100μl/well,每个浓度3个复孔,同时设空白对照孔。受试物6个剂量终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml,将培养板孵育4小时后,各孔加入MTT溶液(5mg/ml)20μl,同样条件继续孵育4小时后终止培养、处理后,在570nm处测各孔OD值,计算抑制率(%),以Bliss法计算药物对肿瘤细胞体外增殖的IC50。试验设计和结果见表8-1。
表8-1 PDK对SGC-7901细胞抑制试验设计和原始数据
(1)输入实验数据,进行工作表Ⅰ和工作表Ⅱ的循环迭代 使用probit模型,通过Bliss迭代法计算出收敛后的工作表Ⅰ(表8-2)和工作表Ⅱ(表8-3)。
表8-2 收敛后的工作表Ⅰ
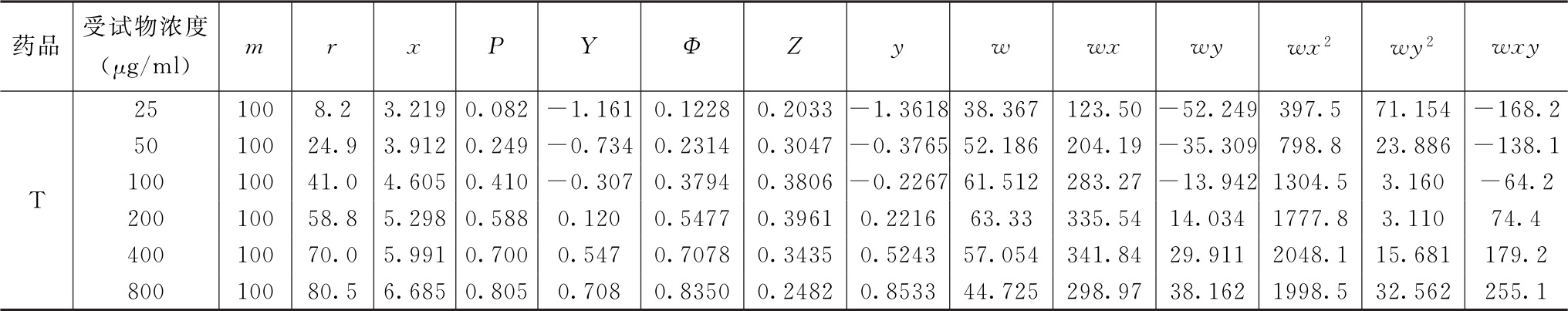
表8-3 收敛后的工作表Ⅱ

(2)可靠性测验 检验非线性:4个自由度的χ2值是3.452,对应P=0.485,统计学不显著。
结论:偏离线性不显著,试验结果成立。
(3)IC50及可信限(FL)计算 IC50及可信限(FL)的计算,按(59)~(63)式计算。
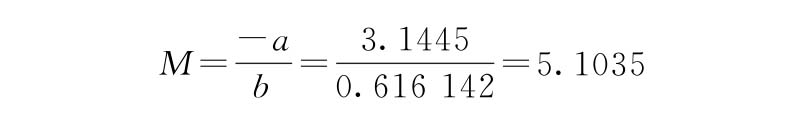
IC50=antilnM=antiln(5.1035)=164.6(μg/ml)
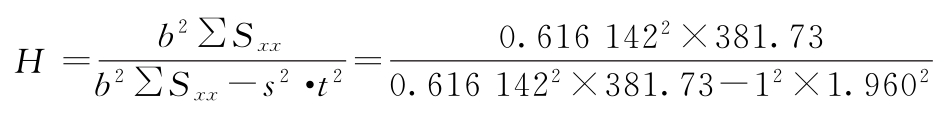
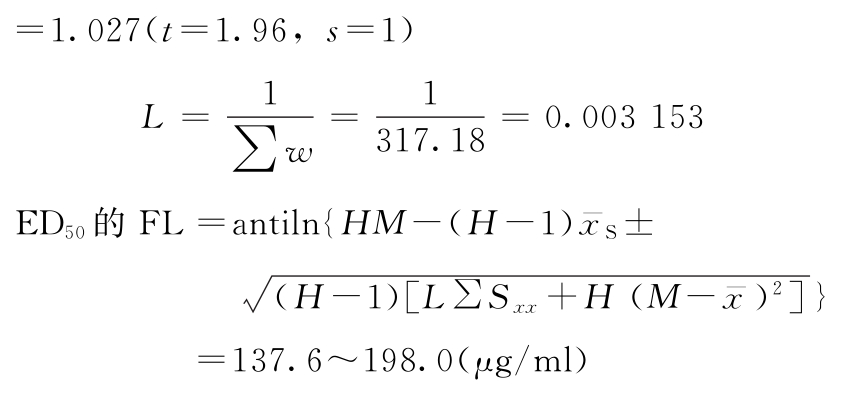
六、实验结果的合并计算
同一批供试品重复n次测定,所得n个测定结果,可用合并计算的方法求其效价PT的均值及其FL。
参加合并计算的n个结果应该是:
(1)各个实验结果是独立的,完整的,是在生物来源、实验条件相同的情况下,与标准品同时比较所得的检定结果(PT);
(2)各次检定结果,经用标示量或估计效价(AT)校正后,取其对数值(lgPT)参加合并计算。
计算时,令lgPT=M
n次实验结果的合并计算可通过下列三种方式进行。
方式1 几何均值法
假定n个独立测定结果的M值呈正态或近似正态分布,则可使用如下公式计算其均值、标准差和标准误。
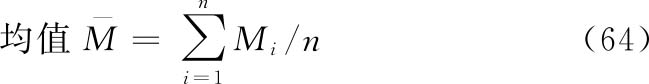
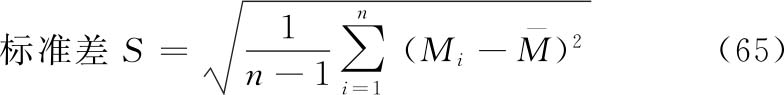

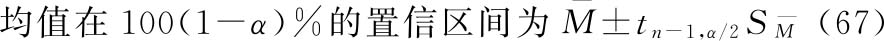
这里,Mi是第i次结果的对数效价值;tn-1,α/2是具有自由度n-1的t分布的上α/2的t值(或双侧α的t值)。
方式2 加权均值法
假定n个独立实验均给出了对数效价值和相应的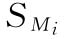 或置信上下限,以及自由度,n次实验结果共n个M值,按(68)式进行χ2测验。
或置信上下限,以及自由度,n次实验结果共n个M值,按(68)式进行χ2测验。
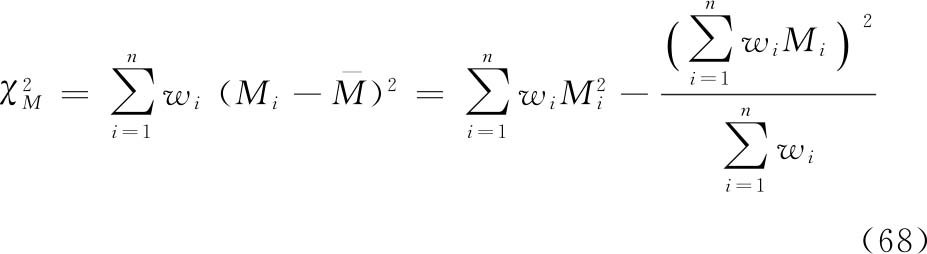
f=n-1
式中 wi为各次实验结果的权重,相当于各次实验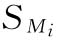 平方的倒数,即
平方的倒数,即


按(68)式的自由度(f)查χ2值表(表十五),得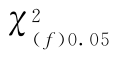 查表值;当χ2计算值小于
查表值;当χ2计算值小于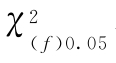 查表值时,认为n个实验结果均一,可按(71)式、(72)式、(73)式计算n个Mi的加权均值
查表值时,认为n个实验结果均一,可按(71)式、(72)式、(73)式计算n个Mi的加权均值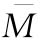 、
、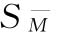 及其FL。
及其FL。
表十五 χ2值表(P=0.05)
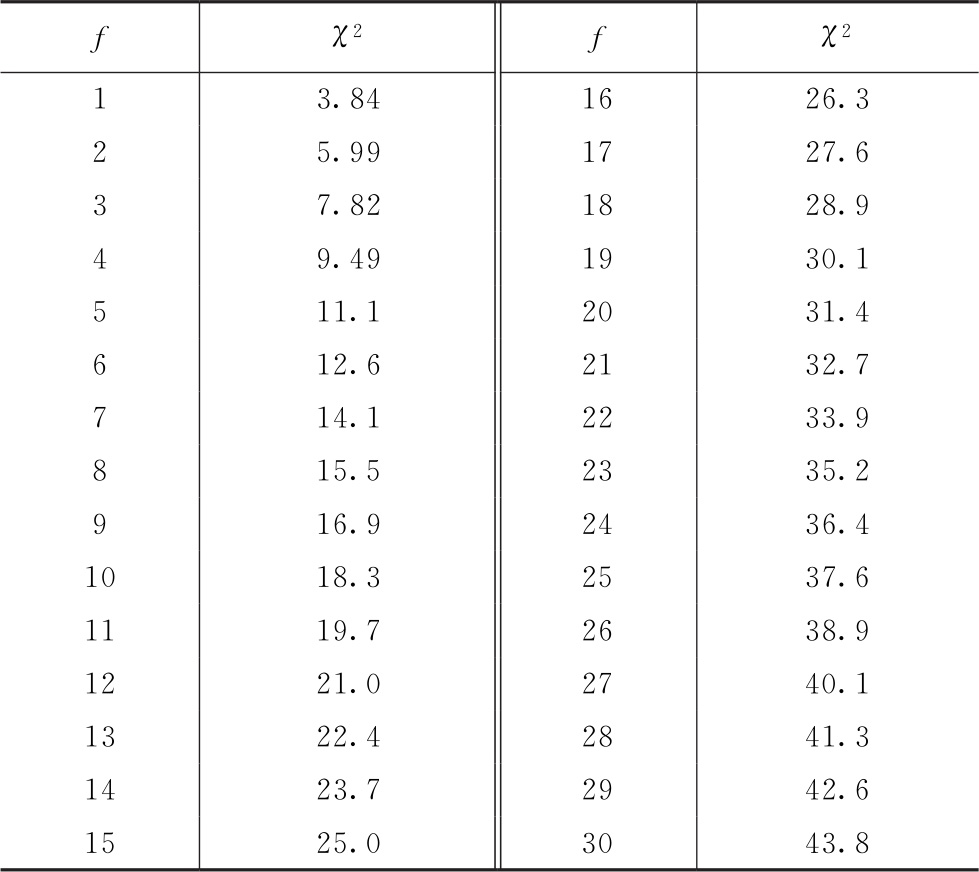
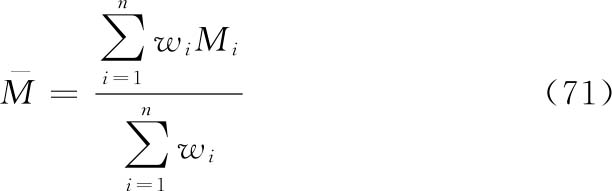
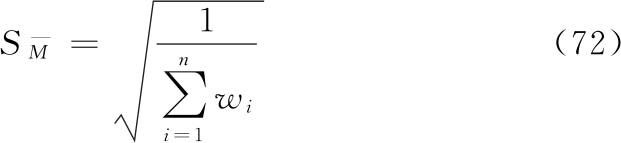
合并计算的自由度(f)是n个实验结果的s2自由度之和,f=∑fi。按此f查表一得t值。
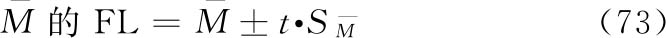
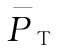 及其可信限按(74)式、(75)式计算:
及其可信限按(74)式、(75)式计算:

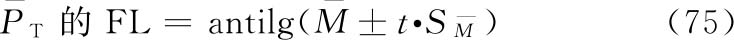
FL%按(8)式计算。
方式3 校正加权均值法
当χ2计算值大于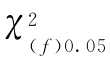 查表值时,认为n个实验结果不均一,可用下列方法进行合并计算。
查表值时,认为n个实验结果不均一,可用下列方法进行合并计算。
(1)如为个别实验结果影响n次实验结果的均一性,可以剔除个别结果,将其余均一的结果按(71)~(75)式进行合并计算,但剔除个别结果应符合“异常值剔除”的要求。
(2)如果n次实验结果的不均一性并非个别实验结果的影响,则按(76)式、(77)式计算各次实验的校正权重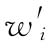 。用
。用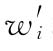 和
和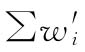 代替(71)式、(72)式中wi和∑wi计算
代替(71)式、(72)式中wi和∑wi计算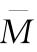 、
、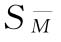 ,再按(73)式、(74)式、(75)式计算M—的FL及其
,再按(73)式、(74)式、(75)式计算M—的FL及其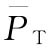 的FL。
的FL。
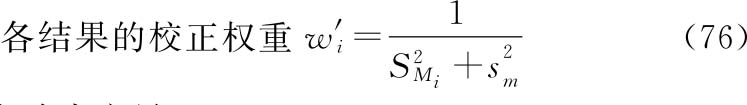
式中 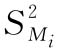 为实验内变异;
为实验内变异;
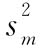 为实验间变异,其计算公式为:
为实验间变异,其计算公式为:
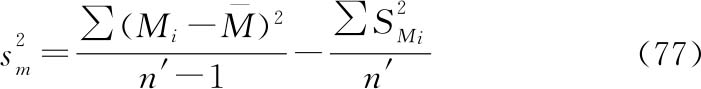
此时,计算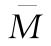 的置信限时,t值通常取2即可。
的置信限时,t值通常取2即可。
注:若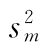 为负值,则用0替代。
为负值,则用0替代。
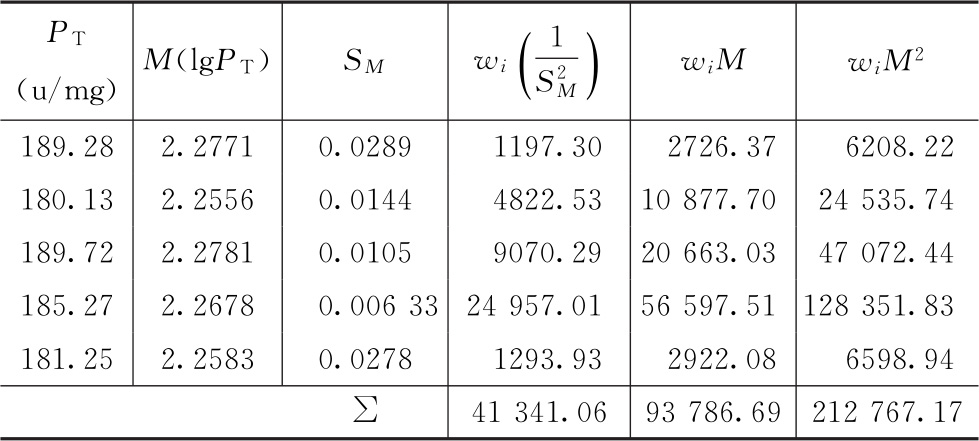
例9 肝素钠5次测定结果的合并计算
测定结果见表9-1。
表9-1 肝素钠的效价测定结果
按(68)式计算:
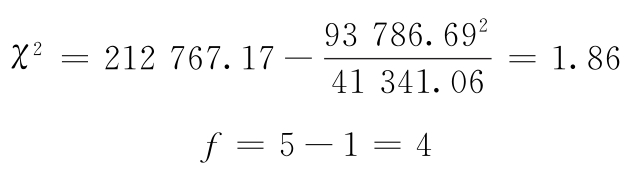
查表十五,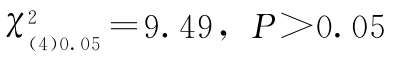
按(71)~(75)式计算:
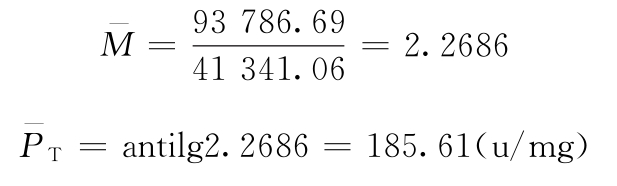

5次实验均用(3.3)法,随机设计,每剂5管,各次实验s2的自由度fi=29-5=24。
合并计算的自由度f=5×24=120,t=1.98

例10 胰岛素6次效价测定结果的合并计算
测定结果见表10-1。
按(68)式计算:

χ2计算值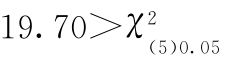 查表值,6次结果不均一,经异常值剔除,无个别删除结果。
查表值,6次结果不均一,经异常值剔除,无个别删除结果。
按(76)式、(77)式计算各次实验结果的校正权重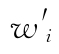 、
、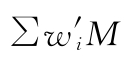 ,得表10-1。
,得表10-1。
表10-1 胰岛素效价测定结果不均一时计算表
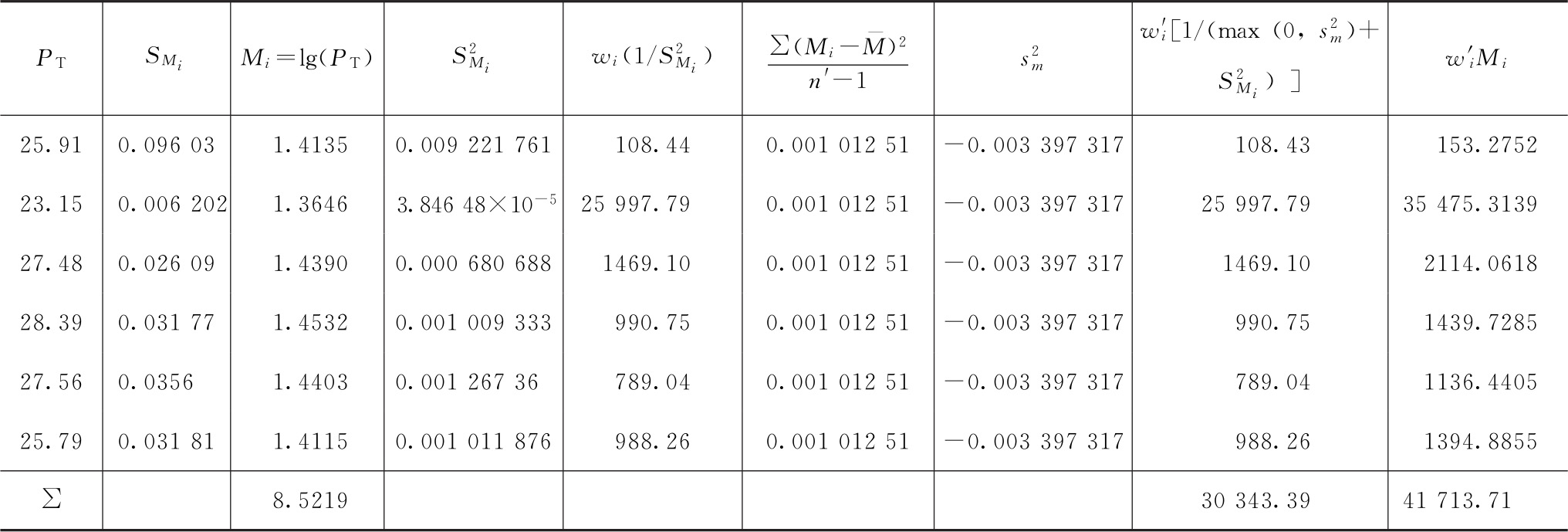
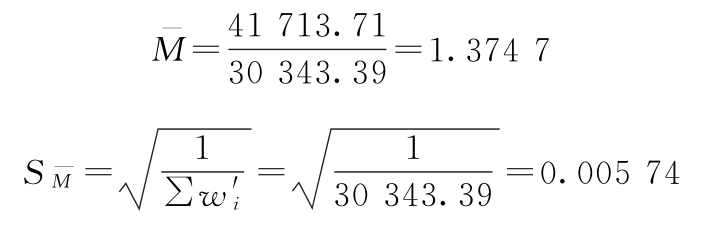
PT=antilg 1.3747=23.70(u/mg)
PT的FL=antilg(1.3747±2×0.005 74)=23.08~24.33(u/mg)
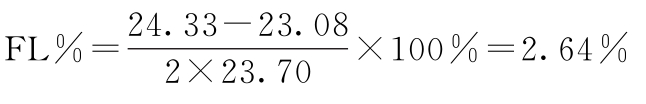
七、符号
A 平行线模型中,SM计算公式中的数值;
四参数回归方程中剂量→0时的y值
AT 供试品的标示量或估计效价
B 平行线模型中,SM计算公式中的数值;
四参数回归方程中半数反应量(EC50)处的斜率因子;
回归线的斜率
C 平行线模型中,缺项所在列各反应值之和;
四参数回归方程中的半数反应量(EC50),为y=(A+D)/2时对应的剂量
Ci 平行线模型中,可靠性测验用正交多项系数
D 平行线模型中,效价计算用系数值,当标准品与待测品剂量数一致时,为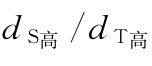 ;当标准品剂量数比待测品剂量数多时,为
;当标准品剂量数比待测品剂量数多时,为 ;反之,则
;反之,则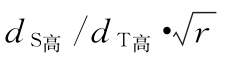 ;四参数回归方程中剂量→∞时的y值
;四参数回归方程中剂量→∞时的y值
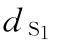 ,
,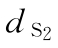 …
…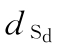 标准品的各剂量
标准品的各剂量
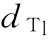 ,
,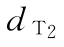 …
…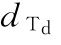 供试品的各剂量
供试品的各剂量
d 四参数回归方程中标准品或供试品的各剂量
EC50或ED50 半数反应量。在四参数量反应中指能引起50%反应强度的剂量,在质反应中指引起50%实验对象出现阳性反应时的剂量
F 两方差值之比,用于方差分析
FL 可信限
FL% 可信限率
f 自由度
G 缺项补足式中除缺项外各反应值之和
g 回归的显著性系数
H 95%置信区间的调整参数(质反应资料计算的中间值,无实际意义)
I 平行线模型中,S和T相邻高低剂量比值的对数,I=lgr
J1,J2… Dixon异常值检验中异常值剔除用的J值(显著性判断标准)
K S和T的剂量组数和
L 供试品和参照品的权重倒数和(质反应资料计算的中间值,无实际意义)
M S和T的对数等反应剂量之差,即效价比值(R)的对数,M=lgR。合并计算中M=lgPT
m 平行线测定法或四参数回归计算法中各剂量组内反应值的个数或动物数
n S和T反应个数之和,四参数回归计算法中S或T的剂量组数
nS 最小效量法S反应的个数
nT 最小效量法T反应的个数
P 概率
p 在质反应资料的probit计算中的r/n比值
PT,PU 供试品(T、U)的测得效价
R S和T等反应剂量(效价)的比值;
随机区组设计中计算缺项反应值公式中的缺项所在行反应值之和
R2 拟合曲线决定系数
RSD 相对标准偏差
r 平行线模型中,S或T相邻高低剂量的比值,即稀释剂间距的表达;
质反应数据中处理组内出现阳性反应的样本数
S 标准品
S1,S2… 平行线测定标准品(S)各剂量组反应值之和,等于S各剂量组的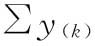
SMM的标准误
s2 实验的误差项
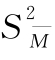 合并计算中各次实验间的差方
合并计算中各次实验间的差方
sm 合并计算中校正均值的标准误
T 供试品
T1,T2… 平行线测定供试品(T)各剂量组反应值之和,相当于T各剂量组的∑y(k)
t 可信限计算用t值,见表一
U 供试品的另一符号
U1,U2… 平行线测定供试品(U)各剂量组反应值之和,相当于U各剂量组的∑y(k)
u 供试品的效价单位
V 平行线测定效价计算用数值,见表十二
W 平行线测定效价计算用数值,见表十二
wi 合并计算中加权均值的各次实验结果的权重
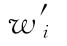 合并计算中校正加权均值的各次实验结果的校正权重
合并计算中校正加权均值的各次实验结果的校正权重
Wc 权重系数
nWc 权重
x 平行线模型中的对数剂量,x=lgd;
四参数模型的实际剂量(相当于d)
xS S的对数剂量或S的对数最小效量
xT T的对数剂量或T的对数最小效量
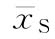 S的对数剂量均值或S的对数最小剂量的均值
S的对数剂量均值或S的对数最小剂量的均值
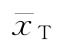 T的对数剂量均值或T的对数最小剂量的均值
T的对数剂量均值或T的对数最小剂量的均值
y 反应值或其规定的函数
ya、ym 特异反应所在组的两极端值
yi,j,k 四参数回归计算法中标准品或供试品每个剂量水平的反应值;其中i表示S或T处理组,i=0时为S处理组,i=1时为T处理组;j表示第j个剂量组;k表示每一剂量水平的第k个重复数
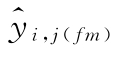 四参数自由拟合方程每一剂量水平的拟合值
四参数自由拟合方程每一剂量水平的拟合值
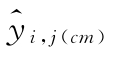 四参数约束拟合方程每一剂量水平的拟合值
四参数约束拟合方程每一剂量水平的拟合值
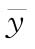 四参数回归计算法中S和T处理组所有反应值的平均值
四参数回归计算法中S和T处理组所有反应值的平均值
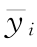 四参数回归计算法中S或T处理组所有反应值的平均值
四参数回归计算法中S或T处理组所有反应值的平均值
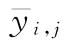 四参数回归计算法中S或T第j个剂量组内反应值的平均值
四参数回归计算法中S或T第j个剂量组内反应值的平均值
Z 正态分布的临界值
∑ 总和
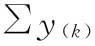 S和T各剂量组反应值之和
S和T各剂量组反应值之和
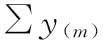 S和T各剂量组内各区组反应值之和
S和T各剂量组内各区组反应值之和
χ2 卡方
Φ 累积标准正态分布函数
(c)蒲标网 - 中国药典、药品标准、法规在线查询 ( 津ICP备15007510号 )


