
b型流感嗜血杆菌结合疫苗
b Xing Liuganshixueganjun Jiehe Yimiao
Haemophilus Influenzae Type b Conjugate Vaccine
本品系用纯化的b型流感嗜血杆菌(Haemophilus influenzae type b,Hib)荚膜多糖抗原,通过己二酰肼与破伤风类毒素蛋白共价结合制成。用于预防b型流感嗜血杆菌引起的儿童感染性疾病,如脑膜炎、肺炎等。
1 基本要求
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造
2.1 菌种
生产用菌种应符合生物制品生产检定用菌毒种管理及质量控制(通则0233)的有关规定。
2.1.1 名称及来源
采用b型流感嗜血杆菌CMCC 58547或CMCC 58534株或其他经批准的菌种。
2.1.2 种子批的建立
应符合生物制品生产检定用菌毒种管理及质量控制(通则0233)的有关规定。
2.1.3 种子批的传代
主种子批启开后传代次数不超过5代;工作种子批启开后至接种发酵罐培养传代次数不得超过5代。
2.1.4 种子批的检定
检定菌种可用含羊血的适宜培养基。
2.1.4.1 培养特性
菌种在普通营养琼脂培养基上不生长,在含羊血的巧克力培养基或在Hib综合琼脂培养基上生长,生长需要Ⅹ因子(氯化血红素)、Ⅴ因子(辅酶Ⅰ);卫星试验阳性,菌落呈灰白色、半透明、光滑凸起,湿润,边缘规则。
2.1.4.2 染色镜检
应为革兰阴性短小杆菌,有荚膜,有时连成线状;亦可有单个革兰阴性球菌。
2.1.4.3 生化反应
发酵葡萄糖、木糖、半乳糖,产酸、不产气。不发酵蔗糖、乳糖和果糖(通则3605)。赖氨酸脱羧酶反应呈阴性。或按经批准的方法进行检定。
2.1.4.4 血清学试验
将在35~37℃培养的菌苔,与Hib免疫血清进行玻片凝集试验,应有强凝集反应。
2.1.5 种子批的保存
种子批应冻干保存于8℃及以下。
2.2 原液
2.2.1 生产用种子
启开工作种子批菌种,经适当传代检查培养特性和染色镜检后接种在适宜培养基上,制备数量适宜的生产用种子。
2.2.2 生产用培养基
采用Hib综合培养基或经批准的其他适宜培养基。
2.2.3 培养
采用培养罐液体培养,在培养过程中取样进行纯菌检查、涂片革兰染色镜检,如发现污染杂菌,应废弃。
2.2.4 收获及杀菌
于对数生长期的后期或静止期的前期收获,取样进行菌液浓度测定及纯菌检查,然后于培养物中加入适宜浓度的甲醛溶液或适宜的杀菌剂杀菌,以确保杀菌完全及不损伤Hib荚膜多糖为宜。
2.2.5 多糖提取和纯化
2.2.5.1 去核酸
将已杀菌的培养物,离心去菌体后收集上清液,采用十六烷基三甲基溴化铵沉淀收集复合多糖。
2.2.5.2 沉淀多糖
乙醇沉淀收集粗制多糖,或超滤浓缩后乙醇沉淀。取上清液,然后加入适宜浓度的乙醇溶液沉淀多糖,并依次用无水乙醇、丙酮洗涤沉淀物,干燥后即为粗制多糖,-20℃或以下保存。
2.2.5.3 多糖纯化
将粗制多糖溶解于醋酸钠溶液中,苯酚抽提,收集上清液;适宜方法去除苯酚后,加入乙醇溶液沉淀多糖,依次用无水乙醇、丙酮洗涤,真空干燥,所得固体即为精制多糖。
2.2.5.4 多糖检定
按3.1项进行。
2.2.5.5 保存及有效期
保存于-20℃或以下,保存时间按批准的要求执行。
2.2.6 多糖衍生
2.2.6.1 将精制多糖溶解后,按适宜比例加入溴化氰进行活化,然后向反应液中加入适宜浓度的己二酰肼溶液,反应适宜时间。再将反应液超滤或透析,可冻干收集固体衍生物。
2.2.6.2 多糖衍生物检定
按3.2项进行。
2.2.6.3 保存及有效期
保存于-20℃或以下,保存时间不超过30天。
2.2.7 载体蛋白
载体蛋白为破伤风类毒素。破伤风类毒素原液制造和检定应符合“吸附破伤风疫苗”2.1~2.2项规定。
可采用柱色谱法或其他经批准的方法对破伤风类毒素原液进一步纯化,并配制至适宜浓度。
2.2.8 多糖蛋白结合物的制备
采用批准的方法进行多糖蛋白结合物的制备。
2.2.9 多糖蛋白结合物原液检定
按3.3项检定。
2.2.10 保存及有效期
保存于2~8℃,保存时间不超过6个月。
2.3 半成品
2.3.1 配制
用氯化钠注射液稀释多糖蛋白结合物原液,每1ml疫苗溶液含多糖应不低于20μg。
2.3.2 半成品检定
按3.4项进行。
2.4 成品
2.4.1 分批
应符合生物制品分包装及贮运管理(通则0239)规定。
2.4.2 分装
应符合生物制品分包装及贮运管理(通则0239)规定。
2.4.3 规格
每瓶0.5ml。每1次人用剂量0.5ml,含多糖10μg。
2.4.4 包装
应符合生物制品分包装及贮运管理(通则0239)规定。
3 检定
3.1 多糖检定
3.1.1 鉴别试验
采用免疫双扩散法(通则3403),本品应与b型流感嗜血杆菌免疫血清形成明显沉淀线。
3.1.2 化学检定
3.1.2.1 固体总量
依法测定(通则3101)。
3.1.2.2 核糖含量
以D-核糖为对照,应为320~410mg/g(通则3421)。
3.1.2.3 磷含量
应为68~90mg/g(通则3103)。
3.1.2.4 蛋白质含量
应小于10mg/g(通则0731第二法)。
3.1.2.5 核酸含量
应小于10mg/g,核酸在波长260nm处的吸收系数(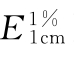 )为200(通则0401)。
)为200(通则0401)。
3.1.2.6 多糖分子大小分布测定
采用琼脂糖CL-4B凝胶柱(1.6cm×100cm)测定,KD≤0.5的多糖回收率应大于50%(通则3419)。
3.1.3 细菌内毒素检查
依法检查(通则1143),应不高于25EU/μg。
3.2 多糖衍生物检定
3.2.1 己二酰肼含量
应为16~45μg/mg(通则3118)。
3.2.2 氰化物残留量
应不高于10ng/mg(通则0806)。
3.3 多糖蛋白结合物原液检定
3.3.1 鉴别试验
采用免疫双扩散法(通则3403),本品应与b型流感嗜血杆菌免疫血清及破伤风类毒素免疫血清形成明显沉淀线。
3.3.2 化学检定
3.3.2.1 多糖含量
以D-核糖为对照,按核糖含量计算结合物中多糖含量,应不低于28μg/ml(通则3421)。
3.3.2.2 蛋白质含量
应不低于48μg/ml(通则0731第二法)。
3.3.2.3 多糖与蛋白质的比值
按3.3.2.1和3.3.2.2测定结果计算,应为0.30~0.59。
3.3.2.4 高分子结合物含量
高分子结合物应为80%~100%或游离多糖≤20%(通则3119)。
3.3.2.5 多糖分子大小分布测定
采用琼脂糖CL-4B凝胶柱(1.6cm×100cm)测定,KD值应不高于0.20,KD值小于0.20的洗脱液回收率应大于60%(通则3419)。
3.3.2.6 碳二亚胺残留量
采用N.Wilchek方法测定,碳二亚胺残留量应低于10μmol/L(通则3206)。
3.3.3 无菌检查
依法检查(通则1101),应符合规定。
3.3.4 细菌内毒素检查
依法检查(通则1143),应不高于5EU/μg。
3.4 半成品检定
无菌检查
依法检查(通则1101),应符合规定。
3.5 成品检定
3.5.1 鉴别试验
采用免疫双扩散法(通则3403),应与b型流感嗜血杆菌免疫血清及破伤风类毒素免疫血清形成明显沉淀线。
3.5.2 物理检查
3.5.2.1 外观
应为无色透明液体,无异物。
3.5.2.2 装量
依法检查(通则0102),应不低于标示量。
3.5.2.3 渗透压摩尔浓度
依法测定(通则0632),应符合批准的要求。
3.5.3 化学检定
3.5.3.1 pH值
依法检查(通则0631),应符合批准的要求。
3.5.3.2 多糖含量
以D-核糖为对照,按核糖含量计算供试品中多糖含量,每1次人用剂量应为10~15μg(通则3421)。
3.5.3.3 高分子结合物含量
高分子结合物应为80%~100%或游离多糖≤20%(通则3119)。
3.5.3.4 多糖分子大小分布测定
采用琼脂糖CL-4B凝胶柱(1.6cm×100cm)测定,KD值小于0.20的洗脱液回收率应大于60%(通则3419)。
3.5.4 无菌检查
依法检查(通则1101),应符合规定。
3.5.5 异常毒性检查
依法检查(通则1141),应符合规定。
3.5.6 细菌内毒素检查
依法检查(通则1143),每1次人用剂量应不高于25EU。
4 保存、运输及有效期
于2~8℃保存和运输。自生产之日起,有效期为24个月。
5 使用说明
应符合生物制品分包装及贮运管理(通则0239)规定和批准的内容。
(c)蒲标网 - 中国药典、药品标准、法规在线查询 ( 津ICP备15007510号 )


