药典目录
生物制品生产检定用动物细胞基质制备及检定规程
来源:三部 分类:生物制品通则 页码:19生物制品生产检定用动物细胞基质制备及检定规程 本规程适用于人用生物制品生产用动物细胞基质及检定用动物细胞,包括具有细胞库体系的细胞及原代细胞。细胞基质系指可用于生物制品生产的所有动物或人源的连续传代细胞系、二倍体细胞株及原代细胞。 生产非重组制品所用的细胞基质,系指来源于未经修饰的用于制备其主细胞库的细胞系/株和原代细胞。生产重组制品的细胞基质,系指含所需序列的、从单个前体细胞克隆的转染细胞。生产杂交瘤制品的细胞基质,系指通过亲本骨髓瘤细胞系与另一亲本细胞融合的杂交瘤细胞系。 —、对生产用细胞基质总的要求 用于生物制品生产的细胞系/株均须通过全面检定,须具有如下相应资料,并经国家药品监督管理部门批准。 (一)细胞系/株历史资料 1. 细胞系/株来源资料 应具有细胞系/ 株来源的相关资料,如细胞系/株制备机构的名称,细胞系/株来源的种属、年龄、性别和健康状况的资料。这些资料最好从细胞来源实验室获得,也可引用正式发表文献。 人源细胞系/株须具有细胞系/株的组织或器官来源、种族及地域来源、年龄、性别、健康状况及病原体检测结果的相关资料。 动物来源的细胞系/株须具有动物种属、种系、饲养条件、组织或器官来源、地域来源、年龄、性别、供体的一般健康状况及病原体检测结果的相关资料。 如采用已建株的细胞系/株,应具有细胞来源的证明资料。应从能够提供初始细胞历史及其溯源性书面证明材料的机构获得,且应提供该细胞在该机构的详细传代记录,包括培养过程中所使用的所有原材料的详细信息,如种类、来源、批号、生产日期及有效期、制备或使用方法、质量标准及检测结果等。 2. 细胞系/株培养历史的资料 应具有细胞分离方法、细胞体外培养过程及细胞系/株建立过程的相关资料,包括所使用的物理、化学或生物学手段,外源插人序列,筛选细胞所进行的任何遗传操作或筛选方法、在动物体内传代过程以及细胞生长特征、培养液成分等;同时还应具有细胞鉴别、内源及外源因子检查结果的相关资料。 应提供细胞传代历史过程中所用的细胞培养液的详细成分并应具有溯源性,如使用人或动物源性成分,如血清、胰蛋白酶、乳蛋白水解物或其他生物学活性的物质,应具有这些成分的来源、批号、制备方法、质量控制、检测结果和质量保证的相关资料。 (二)细胞培养操作要求 细胞取材、建库及制备全过程应具有可溯源性及操作的一致性,并对各个环节的风险进行充分的评估。 1. 细胞来源供体 所有类型细胞的供体应无传染性疾病或未知病原的疾病。神经系统来源的细胞不得用于疫苗生产。 2. 原材料的选择 与细胞培养相关的所有材料,特别是人源或动物源性材料,应按照本版药典的相关要求进行风险评估,选择与生产相适应的原材料,必要时进行检测。所有生物源性材料均应无细菌、真菌、分枝杆菌、支原体及病毒等外源因子污染。细胞培养过程中所用的牛血清及胰酶应符合本版药典的相关要求。 细胞培养液中不得含有人血清。如果使用人血白蛋白,应使用获得国家药品管理当局批准的人用药品。 细胞制备过程中不得使用青霉素或β-内酰胺(β-Lactam)类抗生素。配制各种溶液的化学药品应符合本版药典(二部)或其他相关国家标准的要求。 3. 细胞培养体系 应控制对细胞生长有重大影响的关键的已知可变因素,包括规定细胞培养液及其添加成分的化学组成及纯度;所有培养用试剂应有制备记录并经检定合格后使用,应规定细胞培养的理化参数(如pH值、温度、湿度、气体组成等)的变化范围并进行检测,以保证细胞培养条件的稳定性。 4. 细胞收获及传代 应结合生产工艺的特性,尽可能减少对细胞的操作。细胞收获及传代应采用可重复的方式,以保证收获时细胞的汇合率、孵育时间、温度、离心速度、离心时间以及传代后活细胞接种密度具有一致性。 传代细胞的体外细胞龄可采用细胞群体倍增水平或传代水平计算。 二倍体细胞的细胞龄通常以群体倍增水平计算,也可以每个培养容器细胞群体细胞数为基础,每增加1倍作为1世代粗略估算,即1瓶细胞传2 瓶(1:2分种率),再长满瓶为1世代;1瓶传4瓶(1:4分种率)为2世代;1瓶传8 瓶(1:8分种率)则为3世代。生产用细胞龄限制在细胞寿命期限的前2/3内。 连续传代细胞系的细胞龄可以群体倍增水平计算,也可以按照固定的传代比率进行传代,每传代一次视为一代。 5. 细胞系建立 细胞系建立过程中进行了对细胞特性有重要影响的操作,如导致细胞具有了成瘤性,或经细胞克隆及遗传修饰等操作的细胞,应被视为一个新的(或不同的)细胞系,应在原细胞名称后增加后缀或编号重新命名,并重新建立主细胞库。 在细胞克隆过程中,应选择单个细胞用于扩增,详细记录克隆过程,并根据整合的重组DNA的稳定性、细胞基因组及表型的稳定性、生长速率、目的产物表达水平和完整性及稳定性,筛选具有分泌目的蛋白最佳特性的候选克隆,用于建立细胞种子。 6. 细胞冻存 应在大多数细胞处于对数生长期时进行细胞冻存。应采用符合细胞培养物的最佳冻存方法;每一次冻存时均应采用相同的降温过程,并记录冻存过程。 每一个细胞库冻存时,应将同一次扩增的处于相同倍增水平的细胞培养物合并,混匀后分装。每支冻存管中的细胞数应足以保证细胞复苏后可获得有代表性的培养物。 对于一个新的细胞库,除早代培养物在组织采集时或重组细胞筛选时可能需要使用抗生素外,细胞建库培养时不应使用抗生素。 7. 人员 生产人员应定期检查身体,已知患有传染性疾病的人员不能进行细胞培养的操作。在生产区内不得进行非生产制品用细胞或微生物的操作;在同一工作日进行细胞培养前,不得接触动物或操作有感染性的微生物。 (三)细胞库 细胞库的建立可为生物制品的生产提供检定合格、质量相同、能持续稳定传代的细胞。 细胞建库应在符合中国现行《葯品生产质量管理规范》的条件下制备。 1. 细胞库的建立 三级细胞库管理包括细胞种子、主细胞库(MCB)及工作细胞库(WCB)。在某些特殊情况下,也可采用细胞种子及MCB二级管理,但须得到国务院药品监督管理部门的批准。 (1) 细胞种子(Cell Seed) 由一个原始细胞群体发展成传代稳定的细胞群体,或经过克隆培养而形成的均一细胞群体,通过检定证明适用于生物制品生产或检定。在特定条件下,将一定数量、成分均一的细胞悬液,定量均匀分装于一定数量的安瓿或适宜的细胞冻存管,于液氮或-130℃以下冻存,即为细胞种子,供建立主细胞库用。 对于引进细胞,生产者获得细胞后,冻存少量细胞,经过验证可用于生物制品生产,此细胞可作为细胞种子,供建立主细胞库用。 (2) 主细胞库(MCB) 取细胞种子通过规定的方式进行传代、增殖后,在特定倍增水平或传代水平同次均匀地混合成一批,定量分装于一定数量的安瓿或适宜的细胞冻存管,保存于液氮或-130℃以下,经全面检定合格后,即可作为主细胞库,用于工作细胞库的制备。生产企业的主细胞库最多不得超过两个细胞代次。 (3) 工作细胞库(WCB) 工作细胞库的细胞由MCB细胞传代扩增制成。由MCB的细胞经传代增殖,达到一定代次水平的细胞,合并后制成一批均质细胞悬液,定量分装于一定数量的安瓿或适宜的细胞冻存管,保存于液氮或-130℃以下备用,即为工作细胞库。生产企业的工作细胞库必须限定为一个细胞代次。冻存时细胞的传代水平须确保细胞复苏后传代增殖的细胞数量能满足生产一批或一个亚批制品。复苏后细胞的传代水平应不超过批准用于生产的最高限定代次。所制备的WCB必须经检定合格[见本规程“一、(四)细胞检定”中有关规定] 后,方可用于生产。 2. 细胞库的管理 主细胞库和工作细胞库应分别存放。每一个库应在生产设施内至少2个不同的地点或区域存放。应监测并维护细胞库冻存容器,以保证细胞库贮存在一个高度稳定的环境中。 非生产用细胞应与生产用细胞严格分开存放。 每种细胞库均应分别建立台账,详细记录放置位置、容器编号、分装及冻存数量,取用记录等。细胞库中的每支细胞均应具有细胞系/株名、代次、批号、编号、冻存日期,贮存容器的编号等信息。 为保证细胞冻存后仍具有良好的活力,冻存前的细胞活力应不低于90% ,冻存后应取一定量的可代表冻存全过程的冻存管复苏细胞,复苏后细胞的活力应不低于80%。二倍体细胞冻存后,应至少做一次复苏培养并连续传代至衰老期,检查不同传代水平的细胞生长情况。细胞冻存后,可通过定期复苏细胞及复苏后细胞的活力数据验证细胞在冻存及贮存条件下的稳定性。 (四)细胞检定 细胞检定主要包括以下几个方面:细胞鉴别、外源因子和内源因子的检查、成瘤性/致瘤性检查等。必要时还须进行细胞生长特性、细胞染色体检查、细胞均一性及稳定性检查。这些检测内容对于MCB细胞和WCB细胞及生产限定代次细胞均适用。 细胞检定的基本要求见表1。细胞库建立后应至少对MCB细胞及生产终末细胞(EOPC)进行一次全面检定,当生产工艺发生改变时,应重新对EOPC进行检测。每次从MCB建立一个新的WCB , 均应按规定项目进行检定。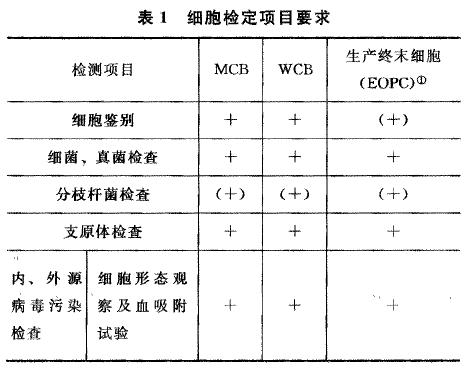
注:①表示生产终末细胞,是指在或超过生产末期时收获的细胞,尽可能取按生产规模制备的生产末期细胞. “+ ”为必检项目,“-”为非强制检定项目。 (+)表示需要根据细胞特性、传代历史、培养过程等情况要求的检定项目。 *表示MCB或WCB。 1. 细胞鉴别试验 新建细胞系/株、细胞库(MCB和WCB)和生产终末细胞应进行鉴别试验,以确认为本细胞,且无其他细胞的交叉污染。细胞鉴别试验方法有多种,包括细胞形态、生物化学法(如同工酶试验)、免疫学检测(如组织相容性抗原、种特异性免疫血清)、细胞遗传学检测(如染色体核型、标记染色体检测)、遗传标志检测(如DNA指纹图谱,包括短串联重复序列(STR)、限制片段长度多态性(RFLP-PCR)和内含子多态性(EPIC-PCR)法等)以及其他方法(如杂交法、PCR法、报告基因法等)。应至少选择上述一种或几种方法对细胞进行种属和细胞株间及专属特性的鉴别。 2. 细菌、真菌无菌检查 取混合细胞培养上清液或冻存细胞管样品,依法检查(通则1101),应符合规定。对于MCB及WCB培养物,至少取混合细胞培养上清液10ml,尽可能采用薄膜过滤法检测。对于冻存细胞,至少取冻存细胞总支数的1%或至少2支冻存细胞管(取量大者),可采用直接接种法检测。 3. 分枝杆菌检查 取至少10^7个活细胞用培养上清液制备细胞裂解物,按照无菌检查法(通则1101)进行分枝杆菌检查。 取细胞裂解物接种于适宜的固体培养基(如罗氏培养基或Middlebrook 7H10培养基),每个培养基接种1ml并做3个重复,并同时以不高于100CFU的草分枝杆菌菌液作为阳性对照。将接种后的培养基置于37℃培养56天,阳性对照应有菌生长,接种供试品的培养基未见分枝杆菌生长,则判为合格。 用于外源病毒检测的豚鼠接种法也可检测分枝杆菌,按表2所列方法进行试验和观察。豚鼠在注射前应观察4周,结核菌素试验为阴性者方可用于试验,观察期末应进行行结核菌素试验,并剖检观察主要脏器是否有结节形成。结核菌素试验为阴性,主要脏器无结节,则为符合要求。 也可釆用经过验证的分枝杆菌核酸检测法替代培养法。 4. 支原体检查 取细胞培养上清液样品,依法检查(通则3301),应符合规定。 5. 细胞内、外源病毒因子检查 应注意检查细胞系/株中是否有来源物种中潜在的可传染的病毒,以及由于使用的原材料或操作带入的外源性病毒。细胞进行病毒检查的种类及方法,须根据细胞的种属来源、组织来源、细胞特性、传代历史、培养方法及过程等确定。如MCB进行了全面检定,WCB需检测的外源病毒种类可主要考虑从MCB到WCB传代过程中可能引入的病毒,而仅存在于MCB建库前的病毒可不再重复检测。 (1) 细胞形态观察及血吸附试验 取混合瓶细胞样品,接种至少6个细胞培养瓶或培养皿,待细胞长成单层或至一定数量后换维持液,持续培养两周。如有必要,可以适当换液。逐日镜检细胞,细胞应保持正常形态特征。 如为贴壁细胞或半贴壁细胞,细胞至少培养14天后,分别取1/3细胞培养瓶或培养皿,用0.2%~0.5%豚鼠红细胞和鸡红细胞混合悬液进行血吸附试验。一半加入红细胞后置2~8℃作用30分钟,一半置20~25℃作用30分钟,分别进行镜检,观察红细胞吸附情况,结果应为阴性。 新鲜红细胞在2~8℃保存不得超过7 天,且溶液中不应含有钙或镁离子。 (2) 体外不同指示细胞接种培养法检测病毒因子 用待检细胞培养上清液制备活细胞或细胞裂解物,分别接种至少下列三种单层指示细胞,包括猴源细胞、人二倍体细胞和同种属、同组织类型来源的细胞。待测样本检测前,可于-70℃或以下保存。 每种单层指示细胞至少接种10^7个活细雕或相当于10^7个活细胞的裂解物。接种量应占维持液的1/4以上,每种指示细胞至少接种2 瓶。取培养7 天的细胞各1 瓶,取上清液或细胞裂解物再分别接种于新鲜制备的相应的指示细胞盲传一代,与初次接种的另一瓶细胞继续培养7天,观察细胞病变,并在观察期末取细胞培养物进行血吸附试验;取细胞培养上清液进行红细胞凝集试验。 用0.2%~0.5%豚鼠红细胞和鸡红细胞混合悬液进行血吸附试验和红细胞凝集试验。将混合红细胞加入细胞培养瓶,一半置于2~8℃孵育30分钟,一半置于20~25℃孵育30分钟,分别进行镜检,观察红细胞吸附情况。取细胞上清液从原倍起进行倍比稀释后,加入混合红细胞,先置2~8℃孵育30分钟,然后置于20~25℃孵育30分钟,分别观察红细胞凝集情况。 接种的每种指示细胞不得出现细胞病变,血吸附试验及红细胞凝集试验均应为阴性。试验应设立病毒阳性对照,包括可观察细胞病变的病毒阳性对照、血吸附阳性性对照及血凝阳性对照。如待检细胞裂解物对单层细胞有干扰,则应排除干扰因素。 若已知待检细胞可支持人或猴巨细胞病毒(CMV)的生长,则应在接种人二倍体细胞后至少观察28天,应无细胞病变,且血吸附试验及红细胞凝集试验均应为阴性。 (3) 动物和鸡胚体内接种法检测外源病毒因子 用待检细胞培养上清液制备活细胞(或适宜时采用相当量的细胞裂解物),接种动物体内进行外源病毒因子检测。待检细胞至少应接种乳鼠、成年小鼠和鸡胚(两组不同日龄)共计4组,如为新建细胞,还需接种豚鼠。原代猴肾细胞还需用家兔体内接种法或兔肾细胞培养法检查猴疱疹B病毒。按表2 所列方法进行试验和观察。接种后24小时内动物死亡超过20%,试验无效。
注:①经尿囊腔接种的鸡胚,在观察末期,应用豚鼠和鸡红细胞混合悬液进行直接红细胞凝集试验。 ②每只家兔于皮内注射10处,每处0.4ml。 观察期内,如被接种动物出现异常或疾病应进行原因分析,观察期内死亡的动物应进行大体解剖观察及组织学检查,以确定死亡原因。如动物显示有病毒感染,则应采用培养法或分子生物学方法对病毒进行鉴定(如观察期内超过20%的动物出现死亡,且可明确判定为因动物撕咬所致),试验判定为无效,应重试。 观察期末时,符合下列条件判为合格。 ① 乳鼠和成年小鼠接种组 至少应有80%接种动物健存,且小鼠未显示有可传播性因子或其他病毒感染。 ② 鸡胚接种组 卵黄囊接种的鸡胚至少应有80%存活,且未显示有病毒感染;尿囊腔接种的鸡胚至少应有80%存活,且尿囊液红细胞凝集试验为阴性。 ③ 豚鼠接种组 至少应有80%接种动物健存,且动物未显示有可传播性因子或其他病毒感染。 ④ 家兔接种组至少应有80%接种动物健存,且动物未显示有可传播性因子或其他病毒感染(包括接种部分损伤。 (4) 逆转录病毒及其他内源性病毒或病毒核酸的检测可采用下列方法对待检细胞进行逆转录病毒的检测。 ① 逆转录酶活性测定 采用敏感的方法,如产物增强的逆转录酶活性测定法(PERT或PBRT法)(本规程附录或其他适宜的方法,但灵敏度不得低于现行方法),但由于细胞中某些成分也具有逆转录酶活性;因此,逆转录酶阳性的细胞,应进一步确认是否存在感染性逆转录病毒。 ② 透射电镜检查法取至少1X10^7个活细胞采用超薄切片法进行透射电镜观察。 ③ PCR法或其他特异性体外法根据细胞的种属特异性,在逆转录酶活性结果不明确或不能采用逆转录酶活性测定时,可采用种属特异性的逆转录病毒检测法,如逆转录病毒PCR法、免疫荧光法、ELISA法等,逆转录病毒的定量PCR法还可用于逆转录病毒颗粒的定量。 ④ 感染性试验将待检细胞感染逆转录病毒敏感细胞,培养后检测。根据待检细胞的种属来源,须使用不同或多种的敏感细胞进行逆转录病毒感染性试验。 不同的方法具有不同的检测特性,逆转录酶活性提示可能有逆转录病毒存在,透射电镜检查及特异性PCR法可证明是否有病毒性颗粒存在并进行定量,感染性试验可证明是否有感染性的逆转录病毒颗粒存在,因此应釆用不同的方法联合检测。若细胞逆转录酶活性检测为阳性,则需进行透射电镜检查或PCR法及感染性试验,以确证是否存在感染性逆转录病毒颗粒。可产生感染性逆转录病毒颗粒,且下游工艺不能证明病毒被清除的细胞基质不得用于生产。 已知鸡胚成纤维细胞(CEF)或其他禽源性细胞含有逆转录病毒序列,常可产生缺陷型逆转录病毒颗粒,逆转录酶活性为阳性,对这类细胞进行逆转录病毒检测时,可直接检测细胞基质中是否存在外源性逆转录病毒污染,如禽白血病病毒、禽网状内皮病肿瘤病毒、感染性内源性逆转录病毒。在某些情况下,也可通过监测鸡群,以保证无上述感染性逆转录病毒污染。 小鼠及其他啮齿类动物来源的细胞系含有逆转录病毒基因序列,可能会表达内源性逆转录病毒颗粒,因此,对于这类细胞系,应进行感染性试验,以确定所表达的逆转录病毒是否具有感染性。对于特定啮齿类细胞(如CHO、BHK21、NS0和Sp2/0),还应确定其收获液中病毒颗粒的量及其是否有感染性逆转录病毒,并应在生产工艺中增加病毒去除和(或)灭活工艺。仅有高度纯化且可证明终产品中逆转录病毒被清除至低于现行检测方法的检测限以下时,方可使用这类细胞。 (5) 种属特异性外源病毒因子的检测 应根据细胞系/株种属来源、组织来源及供体健康状况等确定检测病毒的种类。若在MCB或WCB中未检测到种属特异性病毒,后续过程中不再进行重复检测。 鼠源的细胞系,可采用小鼠、大鼠和仓鼠抗体产生试验(MAP、RAP及HAP)检测其种属特异性病毒。 人源的细胞系/株,应考虑检测如人EB 病毒、人巨细胞病毒(HCMV)、人逆转录病毒(HIV-1/2、HTLV-1/2)、人肝炎病毒(HAV、HBV、HCV)、人细小病毒B19、人乳头瘤病毒、人多瘤病毒、难培养的人腺病毒和人疱疹病毒-6/7/8等。 猴源细胞系/株应考虑检测猴多瘤病毒(如SV40)、猴免疫缺陷病毒(SIV)等。 这类病毒的检测可采用适当的体外检测技术,如分子检测技术,但所用方法应具有足够的灵敏度,以保证制品的安全。 (6) 牛源性病毒检测 若在生产者建库之前,细胞基质在建立或传代历史中使用了牛血清,则所建立的MCB或WCB和(或)生产终末细胞至少应按照通则3604的要求检测一次牛源性病毒。取待检细胞用培养上清液制备成至少相当于10^7个活细胞/ml的裂解物,进行检测。如果在后续生产过程中不再使用牛血清,且MCB和(或)EOPC检测显示无牛源性病毒污染,则后续工艺中可不再重复进行此项检测。 (7) 猪源性病毒的检测 如果在生产者建细胞库之前,细胞基质在建立或传代历史中使用了胰酶,则所建立的MCB或WCB和(或)超过生产限定水平的细胞至少应检测一次与胰酶来源动物相关的外源性病毒,包括猪细小病毒或牛细小病毒。如在后续生产过程中不再使用胰酶,且MCB和(或)EOPC检测结果显示无相关动物源性病毒污染,则后续工艺中可不再重复进行此项检测。如使用重组胰酶,应根据胰酶生产工艺可能引入的外源性病毒评估需要检测的病毒种类及方法。 (8) 其他特定病毒的检测 根据细胞的特性、传代历史或培养工艺等确定检测病毒的种类。有些细胞仅对某些特定病毒易感,采用上述检测方法无法检出,因此需要采用特定的方法检测,如对CHO细胞进行鼠细小病毒污染的检测等。 6. 成瘤性检查 成瘤性检查是确定细胞基质在动物体内是否能够形成肿瘤,是对细胞特性的鉴定。 新建细胞系/株及新型细胞基质应进行成瘤性检查。 某些传代细胞系已证明在一定代次内不具有成瘤性,而超过一定代次则具有成瘤性,如Vero细胞,因此必须进行成瘤性检查。 用于疫苗生产的细胞系/株应进行成瘤性检查,但当未经遗传修饰的二倍体细胞被证明无成瘤性后,可不作为常规检查要求。 已证明具有成瘤性的传代细胞,如BHK21、CHO、HEK293、C127、NS0细胞等,或细胞类型属成瘤性细胞,如杂交瘤细胞,用于生产治疗性制品时可不再做成瘤性检查。 成瘤性检查的方法见本规程附录2。具有成瘤性的新建细胞或新型细胞基质,需釆用定量的方法进一步分析细胞成瘤性的大小,并计算该细胞的半数致瘤量(TPD50),并根据生产工艺及制品的特性,评估成瘤性的风险。 体内法是成瘤性评价的标准,但对于某些细胞,也可采用软琼脂克隆形成试验或器官培养试验等体外法检测细胞的成瘤性,特别是对于低代次、在动物体内无成瘤性的传代细胞系。体外法的结果可作为细胞成瘤性评价的参考。 7. 致瘤性检查 致瘤性检查是保证细胞基质中不存在可使细胞永生化并具有形成肿瘤的因子。细胞基质致瘤性可能与细胞DNA(或其他细胞成分)或细胞基质中含有致瘤性因子相关。来源于肿瘤的细胞或因未知机制形成肿瘤表型的细胞,含有致瘤性物质的理论风险性相对较高。 已建株的二倍体细胞,如MRC-5、2BS、KMB17, WI-38及FRhL-2新建主细胞库不要求进行致瘤性检查。 已建株的或有充分应用经验的连续传代细胞,如CHO、NS0、Sp2/0、低代次的Vero细胞不要求进行致瘤性检查。 新型细胞基质,特别是成瘤性为阳性的细胞,用于疫苗生产时,需进行致瘤性检查。 可采用待测细胞裂解物和(或)细胞DNA按照本规程附录3的方法进行致瘤性检查。如根据细胞基质的表型或来源疑似有致瘤性病毒,建议用细胞基质裂解物接种动物进行致瘤性检查;若细胞基质具有成瘤性表型,建议用细胞DNA接种动物进行致瘤性检查。 对致瘤性检查中出现进行性结节的细胞,应开展进一步的研究,鉴别致瘤性因子或致瘤性活性,并确定细胞的可适用性。 (五)生产细胞培养 生产用原材料的选择和细胞操作环境应符合本规程“一、(二)细胞培养操作要求”及“一、(三)1. 细胞库的建立”中有关规定。 从冻存的WCB中取出1支或多支安瓿,混合后培养,传至一定代次后供生产用。其代次不得超过该细胞用于生产的最高限定代次。生产用细胞的最高限定代次应根据研究结果确定,但不得超过国际认可的最高限定代次。从WCB取出的细胞经增殖后获得的细胞不得再回冻保存用于生产。 二、连续传代细胞系的特殊要求 传代细胞系一般是由人或动物肿瘤组织或正常组织传代或转化而来,可悬浮培养或采用微载体培养,能大规模生产。这些细胞可无限传代,但到一定代次后,成瘤性会增强。应按本规程“一、(四)细胞检定” 的规定进行细胞库的检查。对生产过程中细胞培养的要求如下: 1. 用于生产的细胞代次 用于生产的传代细胞系,代次应有一定限制。用于生物制品生产的细胞最高限定代次须经批准。 2. 生产过程中的细胞检查 除另有规定外,病毒类制品,在生产末期,取不接种病毒的对照细胞,按本规程“一、(四)1. 细胞鉴别试验,2. 细菌、真菌无菌检查,4. 支原体检查” 以及病毒外源因子检查法(通则3302),应符合规定。 三、人二倍体细胞株的特殊要求 新建的人二倍体细胞必须具有以下资料:建立细胞株所用胎儿的胎龄和性别、终止妊娠的原因、所用胎儿父母的年龄、职业及健康良好的证明(医师出具的健康状态良好、无潜在性传染病和遗传性疾患等证明),以及胎儿父系及母系三代应无明显遗传缺陷疾病史的书面资料。 人二倍体细胞株应在传代过程的早期,选择适当世代水平(2~8世代)增殖出大量细胞,定量分装后,置液氮中或-130℃下冻存,供建立细胞种子之用,待全部检定合格后,即可正式定为细胞种子,供制备MCB用。 1. 染色体检查及判定标准 新建人二倍体细胞株及其细胞库必须进行染色体检查。对于已建株的人二倍体细胞株,如WI-38、MRC-5、2BS、KMB17等,在建立MCB时可不必进行细胞染色体检查;但如对细胞进行了遗传修饰,则须按新建细胞株进行染色体检查。 (1) 染色体检查 新细胞建株过程中,每8~12世代应做一次染色体检查,在1株细胞整个生命期内的连续培养过程中,应至少有4次染色体检查结果。每次染色体检查,应至少随机取1000个分裂中期细胞,进行染色体数目、形态和结构检查,并做记录,以备复査。其中至少选择50个分裂中期细胞进行显微照相,作出核型分析,并应粗数500个分裂中期细胞,检查多倍体的发生率。 每次染色体检查,应从同一世代的不同培养瓶中取细胞,混合后进行再培养,制备染色体标本片。染色体标本片应长期保存,以备复查。 可用G分带或Q分带技术检查50个分裂中期细胞染色体带型,并作出带型分析。 (2) 判定标准 对1000个和500个分裂中期细胞标本异常率进行检查,合格的上限(可信限90% Poison法)见表3。
2. 无菌检查 每8~12世代细胞培养物,应进行无菌检查,依法检查(通则1101),应符合规定。 3. 支原体检查 每8~12世代细胞培养物,应进行支原体检查,依法检查(通则3301),应符合规定。 4. 病毒检查 二倍体细胞株传代过程中,至少对2个不同世代水平进行病毒包涵体及特定人源病毒检测[见本规程一、(四)5. (5)种属特异性外源病毒因子的检测],结果应均为阴性。 5. 成瘤性检查 每8~12世代应做一次成瘤性检查[方法见本规程一、(四)6. 成瘤性检查],结果应无成瘤性。 6. 生产过程中的细胞检查 除另有规定外,在生产末期,取不接种病毒的细胞作为对照,进行以下各项检定,应符合规定。 (1) 染色体检查 可根据制品特性及生产工艺,确定是否进行生产过程中细胞的染色体检查。通常含有活细胞的制品或下游纯化工艺不足的制品,应对所用细胞进行染色体检查及评价[见本规程三、1 . (1) 染色体检查及判定标准];但如釆用已建株的人二倍体细胞生产,则不要求进行染色体核型检查。 (2) 细胞鉴别试验 按本规程“一、(四)细胞检定” 项下细胞鉴别试验进行生产用细胞每年应至少进行一次诙项检定。 (3) 无菌检查 依法检查(通则1101),应符合规定。 (4) 支原体检查 依法检查(通则3301),应符合规定。 (5) 对照细胞外源病毒因子检测 依法检查(通则3302),应符合规定。 四、重组细胞的特殊要求 重组细胞系通过DNA重组技术获得的含有特定基因序列的细胞系,因此重组细胞系的建立应具有细胞基质构建方法的相关资料,如细胞融合、转染、筛选、集落分离、克隆、基因扩增及培养条件或培养液的适应性等方面的资料。细胞库细胞的检查除应按本规程“一、(四)细胞检定”的规定进行,还应进行下述检查。 1. 细胞基质的稳定性 生产者须具有该细胞用于生产的目的基因的稳定性资料,稳定性检测的项目及方法依据产品的特性确定,对于细胞基质来说,稳定性的分析是保证MCB/WCB与EOPC之间的一致性,包括:重组细胞的遗传稳定性(如插人基因拷贝数、插入染色体的位点、插人基因的序列等)、目的基因表达稳定性、目的产品持续生产的稳定性,以及一定条件下保存时细胞生产目的产品能力的稳定性等资料。 2. 细胞鉴别试验 除按本规程“一、(四)1. 细胞鉴别试验”进行外,还应通过检测目的蛋白基因或目的蛋白进行鉴别试验。 五、原代细胞的要求 原代细胞应来源于健康的动物脏器组织或胚胎,包括猴肾、地鼠肾、沙鼠肾、家兔肾、犬肾等动物脏器或动物的胎儿和其他组织,以及鸡胚和鹌鹑胚等正常组织,以适当的消化液消化、分散组织细胞进行培养,原代细胞不能建立细胞库,只能限于原始培养的细胞或传代少数几代内(一般不超过5 代)使用,无法事先确定细胞代次。因此,只能严格规范管理和操作措施,以保证以原代细胞为基质所生产的制品质量。 (―)动物组织来源和其他材料 1. 动物组织来源 应符合“凡例”的有关要求。对各种动物都应有明确健康状况和洁净级别要求。 2. 生产或检定用猴 多采用非洲绿猴、恒河猴等,中国以恒河猴为主。应为笼养或小群混养的正常健康猴。动物用于制备细胞前,应有6 周以上的检疫期,检疫期中出现病猴或混人新猴,应重新检疫。从外面新引人的猴群应做结核菌素试验及猴疱疹I型病毒(B病毒)的检查。 胎猴肾可用于生产,对其母猴应进行检疫。 (二)原代细胞培养物的检查 用于细胞制备的动物剖检应正常,取留的器宫组织亦应正常,如有异常,不能用于制备细胞。 1. 细胞培养原材料检查及细胞培养操作 按本规程“一、(二)细胞培养操作要求”项进行。 2. 细胞培养物的检查 (1) 细胞形态检查 细胞在接种病毒或用于生产前,其培养物均应进行外观检查和镜检,应无任何可疑、异常和病变,否则不得用于生产。 (2) 特定病毒检查 原代猴肾细胞培养应检查SV40病毒、猴免疫缺陷病毒和B病毒;应采用Vero或原代绿猴肾细胞、兔肾细胞检查。地鼠肾原代细胞应采用BHK21细胞培养检查。观察细胞形态,如有可疑应在同种细胞上盲传一代继续观察。 (3) 对照细胞检查 依法检查(通则3302),应符合规定。[1] 六、检定用细胞的要求 检定用细胞是指用于生物制品检定的细胞,包括原代细胞、连续传代细胞或二倍体细胞,以及经特定基因修饰过的细胞。检定用细胞的质量对检定结果的判定具有重要的影晌,为保证检定结果的有效性、可靠性及真实性,检定用细胞应符合下列要求。 (一)细胞资料 1. 检定用细胞应具有明确合法来源的证明资料。 2. 如使用传代细胞系/株,应建立细胞库体系,即主细胞库及工作细胞库,如细胞使用量较少,可建立单一主细胞库。应根据制品特性,在保证检测结果可靠性的基础上,通过验证确定该细胞允许使用的最高限定代次,在此基础上规定检定用细胞的使用代次范围。检定时从工作细胞库复苏细胞后,不能再回冻保存。 3. 应详细记录检定用细胞建库的过程,包括细胞培养所用原材料的来源、批号,细胞生长液的配制方法、使用浓度等,以及细胞的传代及冻存过程,并建立细胞冻存及使用台账。 (二)细胞检定 应至少进行以下1~3项检定,根据检定用细胞用途的不同,还应进行以下其他相关项目的检定。 1. 细胞鉴别试验 按本规程“一、(四)1. 细胞鉴别试验”项进行,或其他适宜的方法,应确认为本细胞,并且无其他细胞的交叉污染。 2. 无菌检查 依法检查,应符合要求(通则1101)。 3. 支原体检查 依法检查,应符合要求(通则3301)。 4. 外源病毒污染检查 采用本规程“一、(四)5. (2)体外不同指示细胞接种培养法检测病毒因子”项及本规程“一、(四)5. (3)动物和鸡胚体内接种法检测外源病毒因子”项检查,应无外源病毒污染。 5. 其他检测 (1) 成瘤性检查 用于成瘤性检查的阳性对照细胞,应采用本规程“一、(四)6. 成瘤性检查”项进行检查,应具有成瘤性。 (2) 病毒敏感性检查 用于检测活疫苗制品病毒滴度的细胞,应进行此项检查,证明所用细胞具有足够的相应病毒敏感性。 (3) 细胞功能检查 用于生物学活性、效力或效价测定的细胞,应进行此项检查,证明所用细胞能够有效评价待检样品质量。 附录1 逆转录酶活性检查法 本法系以噬菌体MS2 RNA为模板,经反转录后再采用实时荧光定量PCR法检测特异性扩增信号,从而测定供试品中的逆转录酶活性。 试剂 (1) 供试品稀释液(A 液) 每1L A液含三羟甲基氨基甲烷-盐酸(Tris-HCl,pH7.5)25mmol,氯化钾50mmol,二硫苏糖醇(DTT)5mmol,乙二胺四乙酸二钠(EDTA-Na2,pH8.0) 0.25mmol,Triton X-100 25ml,甘油500ml。配制时,最后添加DTT,混合后分装,-20℃保存,备用。 (2) 供试品保存液(B 液) 每1L A液中含1mg亮抑蛋白酶肽、0.7mg抑胃肽及1mg抑蛋白酶肽。 (3) 引物及探针序列 上游引物:5’-AACATGCTCGAGGGCCTTA-3’ 反转录及下游引物:5’-GCCTTAGCAGTGCCCTGTCT-3’ 探针:5’-(FAM)-CCCGTGGGATGCTCCTACATGTCA-(TAMRA)-3’ (4) 模板 噬菌体MS2 RNA。 (5) 反转录缓冲液 每1L反转录缓冲液含Tris-HCl(pH8.3) 50mmol, 氯化钾 40mmol,氯化镁 6mmol,DTT 2mmol,脱氧核糖核苷酸200μmol,下游引物0.8*10^-3mmol。 (6) 扩增缓冲液可采用市售荧光定量PCR混合液(Mix),每30μl反应体系中,加入上、下游引物各2*10^-8mmol,探针6X10^-9mmol,核糖核酸酶A 10μg。若Mix中不含有Taq DNA聚合酶,可加入2U的Taq DNA聚合酶。 供试品、阳性对照及灵敏度供试品的制备 (1) 取供试品200μl,每分钟5000转离心5分钟,取上清液100μl,加入B液100μl和焦碳酸二乙酯(DEPC)处理的5%Triton X-100 2μl,混匀后,置冰浴15分钟后,置-70℃保存备用。 (2) 阳性对照 用Sp2/0细胞培养上清液作阳性对照,同(1 )处理后,按单次使用量分装,-70℃保存备用。 (3) 标准曲线及灵敏度供试品制备 取0.5μl莫洛尼氏鼠白血病病毒逆转录酶(M-MLVRT)(200U/μl)加至99.5μl A液中,上下吹打10次并涡旋混匀,即将M-MLVRT稀释为10^12pU/μl(1U/μl)。以此样本为初始样本,取5μl至45μl A液中,上下吹打10次并涡旋混匀,如此方法进行10倍系列稀释至10^3pU/μl,每次稀释时均采用新吸头吸取样本。 取10^4~10^9pU/μl稀释度的M-MLVRT作标准曲线各点。10^4pU/μl稀释度样本作为灵敏度供试品。置冰浴备用。 检查法 (1) 反转录 将已处理的供试品及阳性对照用A液做10倍稀释。 反转录反应管中加入反转录缓冲液19.7μl,800ng/μlMS2 RNA 0.3μl,混匀后,标记,70℃放置10分钟,置冰浴。 在相应的反转录反应管中分别加入5μl已稀释的标准曲线样品、供试品、阳性对照及灵敏度供试品,以A液作阴性对照。反转录反应体系为37℃反应4小时。 (2) 实时荧光PCR扩增 取反转录产物加至实时荧光PCR扩增缓冲液25μl中,反应总体系为30μl。混匀后,按下列条件进行扩增:37℃ 7分钟,预变性95℃ 5分钟,然后95℃ 20秒,57℃ 60秒,72℃ 10秒,进行50个循环,在57℃时采集信号,最后72℃延伸2分钟。 结果判定 (1) 实验方法灵敏度认可标准 灵敏度分析:分别检测10^4PU/μl、10^3pU/μl供试品各10个重复。至少10^4pU/μl的供试品应全部检出(10/10),实验方法的灵敏度为合格。 (2) 试验有效性 标准曲线R应不低于0.960,阳性对照应为阳性,Ct值应≤28;灵敏度对照应为阳性,Ct值应≤38;视为试验有效。 (3) 待测样本结果判定 ① 如果待测样本无Ct值结果,或Ct值≥40,且无明显的扩增曲线,则判定待测样本中逆转录酶活性为阴性。 ②如果待测样本的Ct值结果<40,且有明显的扩增曲线,则按照下式计算样本中逆转录酶活性单位:待测样本中逆转录酶活性单位(pU/ml)=A*D*1000 式中 A 为测定值,pU/μl;D 为样本稀释倍数,D=20。 注意事项 (1) 如供试品为培养细胞,则将细胞传代后,培养3~4天长成单层,取上清液检测,取供试品前不得换液。 (2) 试验中所有试剂及吸头均需灭菌。与RNA操作有关的试剤及材料均需经过DEPC处理。 (3) 标准品稀释时,用新吸头吸取上一个稀释度样本加至下一个稀释管中,反复吹吸10次,并涡旋混合均匀,然后换新吸头进行下一个稀释。 (4) 与样本相关的操作建议使用带滤芯吸头,并注意实验分区。 (5) 定期对各区进行消毒,PCR产物及其加供试品吸头应及时进行有效处理。 附录2 成瘤性检查法 成瘤性是指待检细胞接种动物后,接种细胞在动物体内形成(肿)瘤的过程,成瘤性检查的目的是确定细胞基质接种动物后形成(肿)瘤的能力。 待检细胞制备 从MCB或WCB复苏细胞,扩增至或超过生产用细胞龄限定代次10代以上,收获细胞并悬于无血清液体中(如PBS),制备成浓度为每1ml含5*10^7个活细胞的待检细胞悬液,细胞活力应不低于90%,用于成瘤性检测。 阳性对照细胞 用HeLa或HeLa S3细胞或其他已知成瘤性为阳性的细胞,扩增至所需细胞量,用与待检细胞相同的液体悬浮细胞,并制备成浓度为每1ml含5*10^6个活细胞的悬液,细胞活力应不低于90%,作为阳性对照细胞。 阴性对照细胞 如需要,可用人二倍体细胞作为阴性对照,扩增至所需细胞量,用与待检细胞相同的液体悬浮细胞,制备成浓度为每1ml含5*10^7个活细胞的待检细胞悬液,细胞活力应不低于90%,作为阴性对照细胞。 动物 下述两种动物可任选其一: (1) 裸鼠 4~7 周龄,尽量用雌鼠,每组至少10生物制品生产检定用动物细胞基质制备及检定规程只。如使用新生裸鼠,则为3~5日龄。 (2) 新生小鼠3~5日龄,体重8~10g小鼠,每组10只,在出生后第0天、第2天、第7天和第14天,分别用0.1ml抗胸腺血清(ATS)或球蛋白处理后用于试验。 动物接种 待检细胞组每只裸鼠皮下或肌内注射待检细胞0.2ml(即每只裸鼠接种10^7个活细胞)。阳性对照组每只注射阳性对照细胞0.2ml,含10^6个活细胞。皮下接种时细胞应接种于裸鼠背部区域,肌肉接种时细胞应接种于裸鼠大腿部位。对于弱成瘤性表型的细胞或新建细胞,最好再使用新生裸鼠进行成瘤性试验,每只接种0.1m,含10^7个活细胞。 观察 应定期观察及触摸所有动物在注射部位是否有结节形成,至少观察16周(至少4个月),前3~6周,每周观察2次,之后每周观察1次,并记录结果。 结果分析及判定 (1) 如注射部位有结节形成,应对结节进行双向测量,并记录每周的测量结果,以判定结节是否为进行性、稳定还是消退。 (2) 阳性对照组应至少有9只动物有进行性肿瘤生长时,试验才视为有效。 (3) 对出现的结节开始消退的动物,应在观察期末处死。不能形成进行性结节的细胞,不视为具有成瘤性。 细胞在动物体内没有形成进行性结节,但结节在观察期内始终存留,且具有瘤的组织病理学形态时,则需考虑是否需要开展进一步的检测,如延长观察时间或采用新生裸鼠或其他动物模型分析细胞是否具有成瘤性。 (4) 在观察期末,处死所有动物,包括对照组动物,肉眼及显微观察注射部位及其他部位(如心脏、肺、肝、脾、肾、脑及局部淋巴结)是否有接种细胞增生。将这些组织用3.7%~4.0%甲醛溶液固定、切片,并用苏木精和伊红染色后进行组织病理学检查,判定接种细胞是否形成肿瘤或有转移瘤。如果有转移瘤形成,则需进一步分析转移瘤的性质及与原发瘤的相关性,并深入分析转移瘤形成的原因。 (5) 如待检细胞接种组10只动物中至少有1只在注射部位或转移部位形成瘤,并且组织病理学及基因型分析显示形成瘤的细胞性质与接种的细胞一致时,则可判定为待检细胞具有成瘤性。 (6) 如待检细胞接种组10只动物中仅有1只形成瘤且满足(5)的条件,则待测细胞可能具有成瘤性,需要做进一步的分析。 附录3 致瘤性检查法 致瘤性是指将待检细胞的细胞成分接种动物后,诱导动物本身细胞形成肿瘤的特性,可参照下列方法进行检查。 接种动物及数量 采用新生(出生3 日龄内)裸鼠、新生仓鼠及新生大鼠进行致瘤性检查,动物接种数量应多于成瘤性检查用量。 待检细胞 来源于MCB或WCB的细胞扩增至或超过生产用体外细胞龄至少3~10个细胞倍增水平,用于致瘤性检查。 对照 细胞裂解物阳性对照尚不明确,DNA阳性对照可采用含有致瘤性基因的在动物体内可引起致瘤的DNA质粒。设置阴性对照可监测接种动物的自发肿瘤发生频率。设置阴性对照可根据具体情况而定,可采用PBS作为阴性对照。 供试品制备及接种 (1) 细胞裂解物 采用对病毒被坏最小且能最大释放病毒的方法制备细胞裂解物,如可采用3 次冻融及低速离心法,将样本悬浮于PBS中,取含10^7个细胞的裂解物50~100μl分别于肩胛骨处皮下接种新生裸鼠、新生仓鼠及新生大鼠。接种前应确认样本中无活细胞存在,以免影响结果的有效性。 (2) 细胞DNA 提取细胞基质全细胞DNA悬浮于PBS中,可适度进行超声波等剪切处理,取50~100μl含不低于100μg的DNA样本分别于肩胛骨处皮下接种新生裸鼠、新生仓鼠及新生大鼠。阳性对照组应将阳性对照质粒与待测细胞DNA混合后接种,以确认待测样本无抑制效应。 结果观察及分析 (1) 每周观察并触摸接种部位是否有结节形成,应至少观察4 个月。 (2) 观察期内如有1个或多个结节出现,则应每周双向测量结节大小并记录结果,以确定结节是进行性生长、保持稳定还是随时间而消退。有进行性结节生长的动物,当结节达到直径约2cm或国家规定的大小时应处死。 (3) 观察期末,所有动物均应处死,肉眼及显微观察接种部位或其他部位是否有瘤形成。任何疑似瘤均应采用适宜浓度甲醛溶液固定后进行组织学检查。如可行,建立细胞系并冻存后,以备进行后续的分子技术分析。 (4) 显微检查肝、心、肺、脾及局部淋巴结是否存在转移性损伤。如有肿瘤形成,则要分析与接种部位原发瘤的相关性;如组织学检查显示与原发瘤不同,则要考虑可能有自发瘤形成,这种情况需跟踪结果。 结果判定 (1) 观察期末,如接种部位或其他远端部位未观察到进行性生长肿瘤,可判定细胞无致瘤性。 (2) 在致瘤性检查中形成的所有肿瘤均应检查其基因组DNA,分析是否有细胞基质物种来源的DNA及接种动物来源的DNA,致瘤性试验中形成的肿瘤应为接种动物宿主DNA。保存所有的肿瘤样本,以备必要时开展深人研究。 (3) 对致瘤性检查中出现进行性结节的细胞基质,应考虑开展进一步的研究,鉴别致瘤性因子或致瘤性活性,并确定细胞的可适用性。
勘误:
- [1] 在生产末期,取不接种病毒的细胞作为对照,至少按“三、6.(3)~(5)项”要求进行检定,应符合规定。 (2016-8-22)