药典目录
盐酸吉西他滨
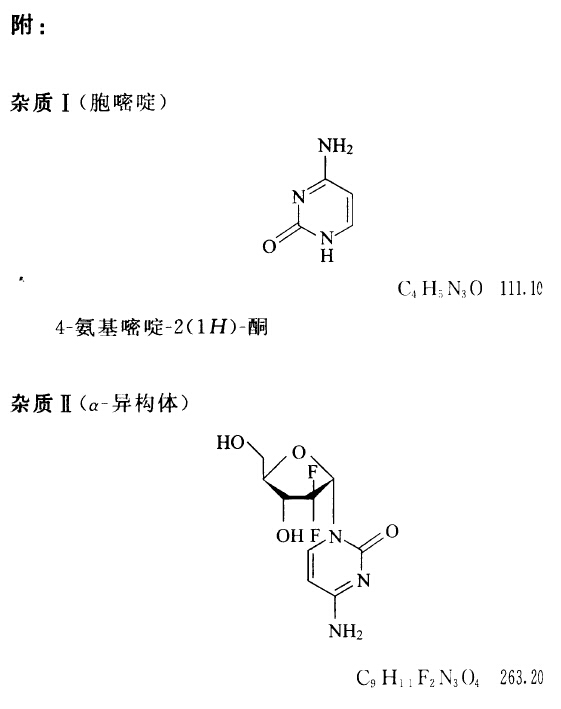
来源:二部 分类:正文品种第一部分 笔画:10 页码:921盐酸吉西他滨 Yansuan Jixitabin Gemcitabine Hydrochloride [1] C9H11F2N3O4·HCl 299.66 本品为2′-脱氧-2′,2′-二氟胞苷(β-异构体)盐酸盐。按干燥品计算,含C9H11F2N3O4·HCl应为98.0%~102.0%。 【性状】本品为白色或类白色结晶性粉末。 本品在水中溶解,在甲醇中微溶,在丙酮中几乎不溶。 比旋度 取本品,精密称定,加水溶解并稀释制成每1ml中约含10mg的溶液,依法测定(通则0621),比旋度为+43°至+50°。 【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间 一致。 (2)取本品适量,加水溶解并稀释制成每1ml中约含l0μg的溶液,照紫外-可见分光光度法(通则0401)测定,在269nm的波长处有最大吸收。 (3)本品的红外光吸收图谱应与对照的图谱(光谱集1014图)一致。 (4)本品的水溶液显氯化物鉴别(1)的反应(通则0301)。 【检查】酸度 取本品0.10g,加水10ml使溶解,依法测定(通则0631),pH值应为2.0~3.0。 溶液的澄清度与颜色取本品0.10g,加水10ml使溶解, 溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更深。 有关物质 精密称取本品适量,加水溶解并定量稀释制成每1ml中约含2mg的溶液,作为供试品溶液;精密称取盐酸吉西他滨对照品与胞嘧啶(杂质I)适量,加水溶解并定量稀释制成每1ml中均约含2μg的溶液,作为对照品溶液。照高效液相色谱法(通则0512)测定,用辛烷基硅烷键合硅胶为填充剂,以0.14mol/L磷酸盐缓冲液(取磷酸二氢钠13.8g与磷酸2.5ml,加水溶解并稀释至1000ml,pH值应为 2.5±0.1)-甲醇(97:3)为流动相A,以0.14mol/L磷酸盐缓冲液-甲醇(50:50)为流动相B;按下表进行梯度洗脱(必要时调整色谱系统,使吉西他滨在8分钟内出峰),检测波长为275nm。取含量测定项下系统适用性溶液20μl,注入液相色谱仪,记录色谱图,出峰顺序依次为胞嘧啶峰、α-异构体 (杂质II)峰与吉西他滨峰,α-异构体峰与吉西他滨峰之间的分离度应大于8.0,吉西他滨峰的拖尾因子应不大于1.5。 精密量取供试品溶液与对照品溶液各20μl,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有杂质峰,胞奋啶按外标法以峰面积计算,不得过0.1%,其余杂质按外标法以吉西他滨峰面积计算,α-异构体不得过0.1%,其他单个未知杂质不得过0.1%,杂质总量不得过0.2%。含量小于0.02%的杂质峰忽略不计。 时间(分钟) 流动相A(%) 流动相B(%) 0 100 0 8 100 0 13 0 100 20 0 100 25 100 0 28 100 0 干燥失重 取本品,在105℃干燥至恒重,减失重量不得过1.0%(通则 0831)。 炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。 重金属 取炽灼残渣项下遗留的残渣,依法检查(通则 0821第二法),含重金属不得过百万分之十。 【含量测定】照高效液相色谱法(通则0512)测定。 色谱条件与系统适用性试验 用辛烷基硅烷键合硅胶为填充剂;以0.14mol/L磷酸盐缓冲液(pH2.5)-甲醇(97:3) 为流动相;检测波长为275nm。取盐酸吉西他滨对照品约10mg,置100ml量瓶中,加氢氧化钾甲醇溶液(取氢氧化钾1.68g,加甲醇10ml,振摇使溶解)4ml,密封,超声使溶解,在55℃水浴加热6~16小时,放冷,用1%磷酸溶液稀释至刻度,摇匀,作为系统适用性溶液(每1ml中约含异构体0.02mg)。取系统适用性溶液20μl,注入液相色谱仪,记录色谱图,异构体峰与吉西他滨峰之间的分离度应大于8.0,吉西他滨峰的拖尾因子应不大于1.5。 测定 法取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含0.1mg的溶液,作为供试品溶液,精密量取 20μl,注入液相色谱仪,记录色谱图;另取盐酸吉西他滨对照品适量,同法测定。按外标法以峰面积计算,即得。 【类别】抗肿瘤药。 【贮藏】遮光,密封,阴凉干燥处保存。 【制剂】注射用盐酸吉西他滨 附: 杂质Ⅰ(胞嘧啶) C4H5N3O 111.10 4-氨基密啶2-(1H)-酮 杂质Ⅱ(α-异构体) C9H11F2N3O4 263.20
勘误:
- [1]

(2016-8-22)


