ICH各地区使用的药典正文评估和建议
Step 5
2007/11/1
关于在ICH区域内评估并推荐采用药典相关要求的指导原则
ICH三方协调指导原则
本指导原则已经进入ICH制定程序的第四阶段,并在2007年11月1日召开的指导委员会会议上向三方注册管理机构推荐采纳
目录
前言
1.1 指导原则的目的
1.2 背景
1.2.1 药典讨论组(PDG)
1.2.2 Q4B专家工作组(EWG)
1.3 指导原则涉及的范围
1.4 一般原则
指导原则
2.1 Q4B评价程序
2.1.1 第一阶段
2.1.2 第二阶段
2.1.3 第三阶段
2.1.4 第四阶段
2.1.5 第五阶段
2.2 附录内容
2.3 药典文本的使用
2.3.1 实施需要考虑的事项
术语
附件Ⅰ ICH Q6A制定期间讨论的通则
附件Ⅱ 供ICH Q4B专家工作组(EWG)评价的药典讨论组(PDG)文件递交
关于在ICH区域内评估并推荐采用药典相关要求的指导原则
1. 前言
1.1 指导原则的目的
本文件描述了由Q4B专家工作组(EWG)对所选的药典文本的评价和推荐程序,希望藉此在各注册管理机构之间达成共识,使药典文本可在ICH各区域内互相替代。如果的评价的结果是肯定的,ICH将以专题的形式发布附件(即Q4B结果),附件中包括药典文本的具体信息和执行方法。制定实施Q4B附件的目的在于避免企业进行重复繁琐的的试验。
1.2 背景
在发布Q6A(质量标准:新原料药和新药制剂的分析方法和接受标准:化学原料药)和Q6B(质量标准:生物技术/生物制品的分析方法和接受标准)时,ICH就已经认识到,这两个指导原则的充分实施及其价值体现将直接依赖于药典文本使用的成功协调,因此ICH也鼓励药典讨论组在这一方面进行探索性的工作。
1.2.1 药典讨论组(PDG)
PDG成立于1990年,由隶属欧洲议会的欧洲药品质量委员会(EDQM)、日本厚生省(MHLW)和美国药典委员会(USP)的代表组成。通过独立的公众评议和咨询,药典讨论组制定协调药典文本,并适时地在ICH会议上报告其协调讨论的结果。
1.2.2 Q4B专家工作组(EWG)
2003年11月,ICH成立了Q4B专家工作组来评价并推荐在ICH三方区域内使用的药典文本。Q4B专家工作组曾经预期,药典讨论组将成为推荐药典文本的主要来源。但有时并非药典讨论组的三方成员都参与协调某一具体药典方法,Q4B专家工作组也可以接受一方或两方药典讨论组提出的药典协调建议。
1.3 指导原则涉及的范围
最初,Q4B评价程序的重点设定在ICH Q6A起草时讨论的11个检检查方法通则上(参见附录Ⅰ);但目前,一些其它的药典协调建议也在研究和提出,并考虑进入Q4B评价程序。
1.4 一般原则
专家工作组将对提出的药典文本进行评价,并评估其对药品注册可能产生的影响。按照Q4B评价程序,Q4B专家工作组将在必要时继续与药典讨论组展开对话。通过评价,Q4B专家工作组将形成结论,并在ICH区域内推荐使用药典文本,该结论和推荐意见将通报至ICH指导委员会。对于每项通过评价的建议,根据ICH工作程序,Q4B专家工作组会在Q4B指导原则下建立一个特定专题的附录。附录将提供药典文本在ICH区域内如何使用的信息。每个附录都将作为Q4B指导原则下的独立配套文件发布。
为保证公开透明,对已纳入Q4B评价程序的药典文本进行的任何修订都应及时告知Q4B专家工作组。针对修订的具体内容,Q4B专家工作组不仅会评价修订的好处,还会考虑该项修订是否将导致Q4B采取进一步的关联行动。
2. 指导原则
2.1 Q4B评价程序
文件递交至Q4B专家工作组后,评价程序随即启动。对于PDG建议提出的药典文本,讨论组应在在PDG的5B阶段签发后(参见附录Ⅱ)尽早递交。递交的文件应概述需解决的问题,并同时提交相关的支持性数据。
当Q4B评价程序形成结论并建议药典文本可在ICH区域内互相替代时,按下述ICH程序建立Q4B专题附录。
2.1.1 第一阶段
每个Q4B成员方将分别评估提出的药典文件对药品注册的影响。由于在评估过程中可能会出现不同的意见和分歧,Q4B专家工作组间的讨论、以及与递交部门(如:药典讨论组)之间的交流/对话均可能发生(如下图例所示)。
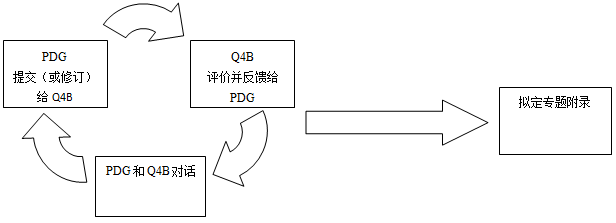
当Q4B评价程序结果认为可以推荐该药典文本在ICH区域内互相替代时,Q4B专家工作组将拟定并签署一份Q4B附录的草稿,并将该草稿递交至ICH指导委员会供第二阶段采纳。
2.1.2 第二阶段
基于Q4B专家工作小组的报告,已经在技术问题上达成充分的科学共识,指导委员会同意附录草案进入第三阶段-进行注册方面的意见征询和讨论。
2.1.3 第三阶段
Q4B附录草案在ICH的三方区域内进行意见征询(时间一般为3个月)。注册方面的意见征询和讨论主要集中在附录中的Q4B结果上。Q4B专家工作小组可以根据收到的意见修订附录,并将附录草案的终稿递交至ICH指导委员会。
2.1.4 第四阶段
ICH指导委员会采纳附录并将其作为ICH Q4B指南的一个独立配套文件发布。
2.1.5 第五阶段
附录进入区域内注册实施阶段。
2.2 附录内容
Q4B附录中至少应包括以下信息,并可根据具体情况增加其他信息。
题目;
前言;
Q4B结果;
如果适用,可以提供帮助相关人员使用参考的药典文本的说明;
实施时限,注册管理人提出的关于何时可以替代使用药典文本的时间表;
如果适用,可以提供关于分析方法和接受标准的参考文献。
2.3 药典文本的使用
在ICH区域内实施Q4B附录之后,附录中所参考的官方药典文本可在区域内互相替代。在区域内的任何一般和/或特殊的实施建议将在Q4B专题附录的第四节-实施需要考虑的事项-提供。其中的基本信息如下:
2.3.1 实施需要考虑的事项
一般考虑事项:当申办者或生产商将其现有方法修订为已实施的经Q4B评价的药典文本的方法时(参见附录第二节),任何关于修订内容的通告,变更和/或批准前申报程序,均应符合当地的注册机制中与药典各论变更相关的技术要求。
除以上的一般性考虑事项外,各注册区域内的特定信息将有助于附件内容在该地区的实施。各注册区域可结合本地区附录的实施情况为有关人员提供此类注释说明。
FDA的考虑事项:基于上述推荐,并结合附录的相关规定,附录第二节所参考的药典文本可以考虑互相替代。但是, 不论的方法的来源如何,FDA仍然可能要求企业证明其所选方法对于某一特定的原料和制剂的可接受性和适用性。
EU的考虑事项:对于欧盟,欧洲药典的各论具有强制性。基于上述可以替代的声明,在符合本附录要求的条件,并满足欧州药典各章节[章节名称和欧洲药典参考文献]要求的情况下,管理当局可以接受在上市许可申请、再注册或变更申请中引用第二节所述其他药典相关内容作为参考。
MHLW的考虑:结合附录的相关规定,附录第二节所参考的药典文本可互相替代。当本附录实施时,MHLW将在通告中提供具体实施细则。
3. 术语
文件递交
从药典讨论组或一个或多个药典机构(美国药典、欧洲药典或日本药典)获得的工作文件(包含推荐采纳的药典文本和任何其他用于Q4B评价的支持性文件)的过程。
可互相替代
这种情况是指,就药品的注册/审批程序而言,在ICH区域内,来自日本药典、欧洲药典或美国药典的特定文本均可互相替代(在恰当引用的前提下)。对于任何可互相替代的方法,分析人员均可得出相同的可接受或不可接受的结论。而无需考虑该文本是来自哪一个具体的PDG成员国药典。
PDG
由隶属欧洲议会的欧洲药品质量委员会(EDQM)、日本厚生省(MHLW)和美国药典委员会(USP)等代表组成的三方药典讨论组。
药典文本
是指来自ICH三方药典的各论、通则和分析方法等。
Q4B结果
通过Q4B评价程序产生,包含了如何使用已经评价的药典文本的信息,作为通过评价的一个结果,以Q4B专题附录的形式发布。
附件Ⅰ
ICH Q6A建立期间讨论的通用章节(总则)

附件Ⅱ
用于ICH Q4B专家工作组(EWG)评价的PDG文件的递交程序
药典讨论组文件递交示例:
在药典讨论组5B阶段签发后,一般在六个月内,协调药典组代表药典讨论组通过ICH秘书处向Q4B专家工作组提供下列文本和信息(指南中称为“文件递交”),并将复印件提交至Q4B专家工作组报告起草人(作为告知):
1) 包含药典讨论组协调文本的药典讨论组签发文件,(药典讨论组5B阶段)。
2)对以下特殊问题的简短说明:
a.在一部或多部药典之间尚存的差异,包括从协调的角度对差异进行的评论;
b.与发布有关的的任何特殊问题;
c.如果进行过任何等效性研究,对研究结果进行概述;
d.在每部药典中的计划发布和实施的时间表;
e.以上尚未包含的其他信息。
3)拟推荐采纳和发布的药典文本,以及对于签发文本存在区域差异的说明。
4)药典协调时,其他阐述性的信息由一部或多部PDG药典收入各自的具体注释章节。因此,包含该内容(以草稿形式指明出处)的药典修订信息需要与提交的文件一并提供。
如果在递交Q4B后发生变更或者发现其它差别时,相关药典机构应及时告知Q4B专家工作组。
(c)蒲标网 - 中国药典、药品标准、法规在线查询 ( 津ICP备15007510号 )


